Mogelijk geen noodzaak voor monitoring anti-Xa-topspiegel bij tinzaparinegebruikers met verminderde nierfunctie
- Rubriek: Korte bijdrage
- Identificatie: 2025;10:a1795
Kernpunten
- Bij behandeling met therapeutisch gedoseerd laagmolecuulgewicht heparine adviseert de richtlijn Antitrombotisch beleid om anti-factor Xa (anti-Xa)-monitoring te overwegen bij verschillende patiëntengroepen, zoals patiënten met een verminderde nierfunctie.
- Therapeutisch gedoseerd tinzaparine (zonder pre-emptieve dosisreductie) leidt niet tot verhoogde anti-Xa-topspiegels bij patiënten met een geschatte glomerulaire filtratiesnelheid (eGFR) ≤ 30 mL/min.
- Anti-Xa-monitoring op basis van anti-Xa-topspiegels bij therapeutisch gedoseerd tinzaparine lijkt niet noodzakelijk voor patiënten met een eGFR ≤ 30 mL/min.
Abstract
Monitoring of anti-Xa peak levels may not be necessary in tinzaparin users with renal insufficiency
Background
Low-molecular-weight heparins (LMWHs) are widely used anticoagulants, with tinzaparin being one of the less frequently prescribed options. The necessity of anti-factor Xa (anti-Xa) monitoring in patients with renal insufficiency receiving tinzaparin remains uncertain.
Objective
This study aims to describe anti-Xa peak levels of tinzaparin and to assess the need for anti-Xa monitoring in tinzaparin users with renal insufficiency (estimated glomerular filtration rate [eGFR] ≤ 30 mL/min/1.73 m2 or with continuous veno-venous hemofiltration [CVVH]). Additionally, we tried to assess a potential relation between anti-Xa peak levels and tinzaparin dosage.
Design
Retrospective cohort study.
Methods
This retrospective cohort study analysed anti-Xa measurements for therapeutically dosed tinzaparin from June 1, 2022, to May 15, 2023, in patients treated at the IJsselland Hospital. Patient characteristics, dosing, and anti-Xa peak levels were collected. Descriptive statistics and the Mann-Whitney U test (P < 0.05) were used for data analysis.
Results
A total of 70 anti-Xa measurements from 33 different patients were included. The median anti-Xa level was 0.79 IU/mL, with 41.4% of the measurements taken from patients with CVVH or an eGFR of 30 mL/min/1.73 m² or lower. The median anti-Xa level was below the target range (1.0-2.0 IU/mL) for all patients, regardless of renal insufficiency. Furthermore, there was no significant difference between anti-Xa peak levels in patients with and without renal insufficiency (median 0.64 IU/mL eGFR ≤ 30 mL/min/1.73 m2 or CVVH and median 0.82 IU/mL eGFR > 30 mL/min/1.73 m2; P = 0.124). No correlation was found between tinzaparin dosage and anti-Xa peak levels.
Conclusion
Our findings suggest that anti-Xa monitoring may not be necessary in tinzaparin users with renal insufficiency. The median anti-Xa peak levels were below the target range, and no significant difference was observed in the anti-Xa peak levels between patients with and without renal insufficiency. No accumulation of tinzaparin was observed. Further research with a larger sample size could strengthen these results and potentially avoid unnecessary anti-Xa monitoring.
Inleiding
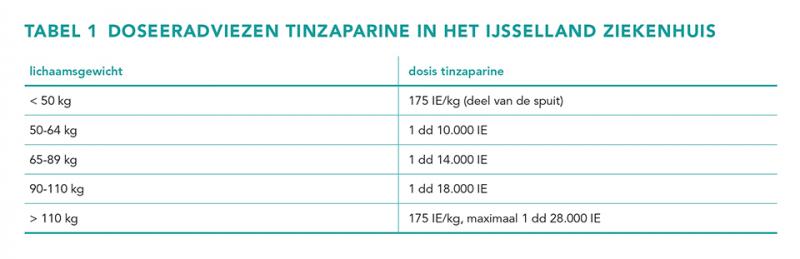
Laag-molecuulgewicht heparines (LMWH’s) zijn antitrombotica die zijn verkregen door de degradatie van ongefractioneerd heparine [1]. Tinzaparine wordt minder frequent ingezet als antitrombotische behandeling met LMWH, met in 2022 slechts 2420 gebruikers extramuraal in Nederland, vergeleken met 105.430 gebruikers van nadroparine en 55.037 van dalteparine [2]. Net als andere LMWH’s wordt tinzaparine therapeutisch gedoseerd op basis van lichaamsgewicht, met een dosis van 175 IE/kg Mogelijk geen noodzaak voor monitoring anti-Xa-topspiegel bij tinzaparinegebruikers met verminderde nierfunctie lichaamsgewicht per dag en maximaal 28.000 IE per dag bij patiënten met een body mass index (BMI) ≥ 40 kg/m2 (voorheen morbide obesitas). In tegenstelling tot andere LMWH’s is tinzaparine alleen geregistreerd voor eenmaaldaagse dosering [3].
Tijdens behandeling met een LMWH kan de mate van antistolling worden gemonitord met behulp van de antifactor-Xa (anti-Xa)-activiteit. Deze bepaling meet de mate van remming door het LMWH antitrombine-heparinecomplex op stollingsfactor Xa [4]. De referentiewaarden zijn gebaseerd op topspiegels (afname 4 uur na de gift) en zijn 1,0-2,0 IE/mL bij eenmaal daags doseren en 0,6-1,0 IE/mL bij tweemaal daags doseren [5].
In de landelijke richtlijn Antitrombotisch beleid [5] wordt aanbevolen om anti-Xa-monitoring te overwegen bij zwangeren, neonaten en kinderen, BMI > 50 kg/m2, patiënten met een geschatte glomerulaire filtratiesnelheid (eGFR) < 30 mL/min, trombose tijdens therapie, of couperen tijdens de antistollingstherapie voor het opstellen van de optimale behandelstrategie. De literatuur over anti-Xa-spiegels bij LMWH-gebruikers met een verminderde nierfunctie is beperkt, en er zijn tegenstrijdige publicaties [6,7], waardoor er geen consensus is. In het reviewartikel van Van den Broek et al. [6] werden twee onderzoeken meegenomen die geen correlatie vonden tussen de creatinineklaring en anti-Xa-piekconcentraties bij patiënten met een verminderde nierfunctie (20-29 mL/min) en de anti-Xa-piekconcentraties van patiënten zonder een verminderde nierfunctie (> 50 mL/min). De auteurs concludeerden dat er meer data nodig zijn over hoe de klaring van LMWH anti-Xa wordt beïnvloed door verschillende gradaties van nierinsufficiëntie.
Voor tinzaparine wordt, in tegenstelling tot andere LMWH’s, door de KNMP Kennisbank geen dosisverlaging geadviseerd bij een verminderde nierfunctie, omdat tinzaparine door het relatief hoge molecuulgewicht (circa 6500 Da) in mindere mate renaal wordt geklaard [3,5]. Volgens de richtlijn Antitrombotisch beleid wordt echter voor specifieke patiëntengroepen geadviseerd anti-Xa-monitoring uit te voeren. In het huidige onderzoek worden anti-Xa-topspiegels beschreven van patiënten met een verminderde nierfunctie (eGFR ≤ 30 mL/min/1,73 m2 of continue veno-veneuze hemofiltratie [CVVH]) en zonder verminderde nierfunctie die worden behandeld met therapeutisch gedoseerd tinzaparine. Daarnaast zijn de anti-Xa-topspiegels van patiënten met een verminderde nierfunctie (eGFR ≤ 30 mL/min/1,73 m2 of CVVH) en zonder verminderde nierfunctie met elkaar vergeleken. Tevens is gekeken naar een mogelijke relatie tussen de anti-Xa-topspiegels en de dosering tinzaparine. Tot slot is nog ter exploratie gekeken naar het aantal bloedingen tijdens de behandeling met tinzaparine.
Methoden
In dit retrospectieve cohortonderzoek zijn anti-Xa-uitslagen verzameld van patiënten ≥ 18 jaar die behandeld werden in het IJsselland Ziekenhuis in de periode 1 juni 2022-15 mei 2023. Alleen uitslagen van patiënten die met therapeutisch gedoseerd tinzaparine werden behandeld, werden geïncludeerd. Uitslagen met een afnametijdstip < 3 of > 5 uur na toediening werden geëxcludeerd. De volgende kenmerken zijn verzameld uit het elektronisch patiëntendossier (HiX 6.3): leeftijd, geslacht, BMI, nierfunctie (CKD-EPI), aanwezigheid van CVVH, indicatie voor antistolling, toedientijd en dosering. Voor de nierfunctie en de BMI werd de meest recente waarde op het moment van de anti-Xa-meting gebruikt.
De dosering tinzaparine werd onderverdeeld in de volgende categorieën: onderbehandeling, adequate dosering conform intern antistollingsbeleid en overbehandeling. Voor deze indeling is gebruik gemaakt van de dosisadviezen die gelden in het IJsselland Ziekenhuis, waarbij op de dichtstbijzijnde hele spuit wordt afgerond (tabel 1). Voor een adequate behandeling is de standaarddosering van 175 IE/kg lichaamsgewicht aangehouden. Bij een dosering < 80% van de standaarddosering werd de dosis geclassificeerd als onderbehandeling en bij een dosis > 120% werd de dosis geclassificeerd als overbehandeling. Als exploratieve vraag werd ook gekeken naar het aantal bloedingen tijdens de tinzaparinebehandeling. Hiervoor is de naslag van opnamedagen van elke patiënt met tinzaparinebehandeling gescreend op bloedingen.
Voor het analyseren van de data is MS Excel (Microsoft 365) en IBM SPSS Statistics (versie 27.0) gebruikt. Om te onderzoeken of er een verschil is tussen de anti-Xa-topspiegels bij patiënten met een nierfunctie ≤ 30 mL/min/1,73 m2 of CVVH en patiënten met een nierfunctie > 30 mL/min/1,73 m2 is gebruikt gemaakt van de Mann-Whitneytoets, met een significantieniveau van 0,05. Vanwege de retrospectieve opzet was informed consent niet nodig.
Resultaten
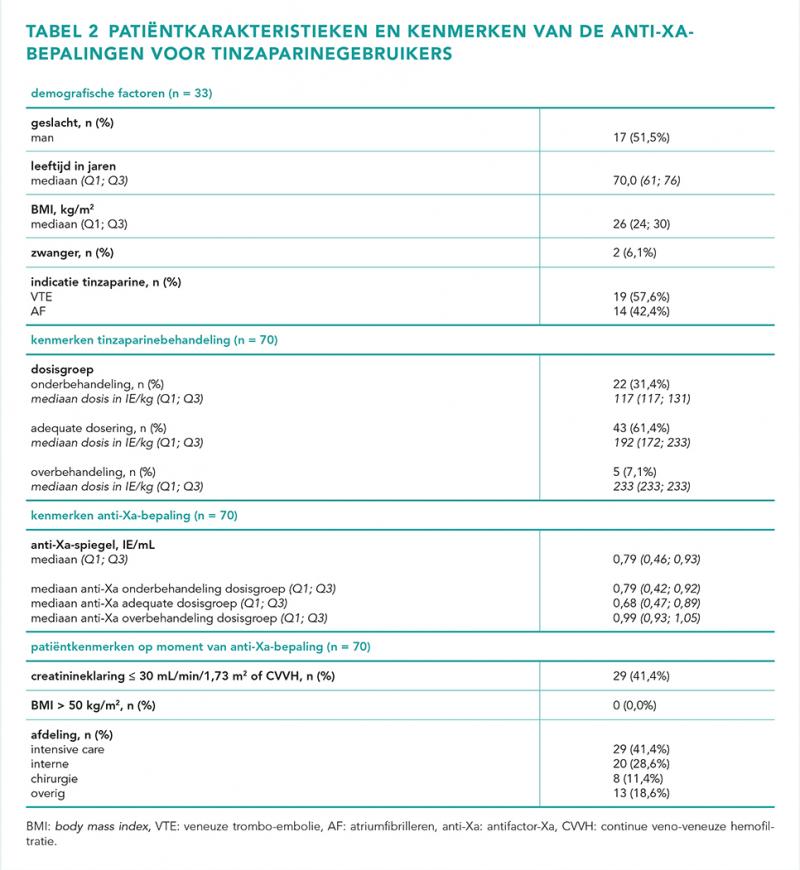
Van de 71 anti-Xa-bepalingen werd één uitslag geëxcludeerd vanwege afname > 5 uur na de gift. Er werden 70 uitslagen geïncludeerd van 33 verschillende patiënten (mediaan: 1 bepaling per patiënt). Het betroffen met name klinische patiënten; slechts één anti-Xa-bepaling werd uitgevoerd bij een poliklinische patiënt (1,4%). De patiëntkarakteristieken en de kenmerken van de anti-Xa-bepalingen staan weergeven in tabel 2.
Uit de dataset bleek dat bij 29 bepalingen (41,4%) bij in totaal 17 patiënten een verminderde nierfunctie (≤ 30 mL/min/1,73 m2 of CVVH) de aanleiding was om de anti-Xa-spiegel te controleren. Hierbij ging het om 8 bepalingen (11,4 %) bij in totaal 6 patiënten die CVVH ondergingen. Er werden geen bepalingen uitgevoerd vanwege een BMI > 50 kg/m2. De anti-Xa-spiegels lagen grotendeels (84,3%) onder de gebruikelijke streefwaarden (1,0-2,0 IE/mL) met een mediaan van 0,79 IE/mL. Geen van de gemeten anti-Xa-waarden lag boven de referentiewaarden. De meeste anti-Xa-bepalingen (61,4%) waren uitgevoerd bij patiënten die een adequate dosering kregen en bij 31,4% van de bepalingen ging het om onderbehandeling.
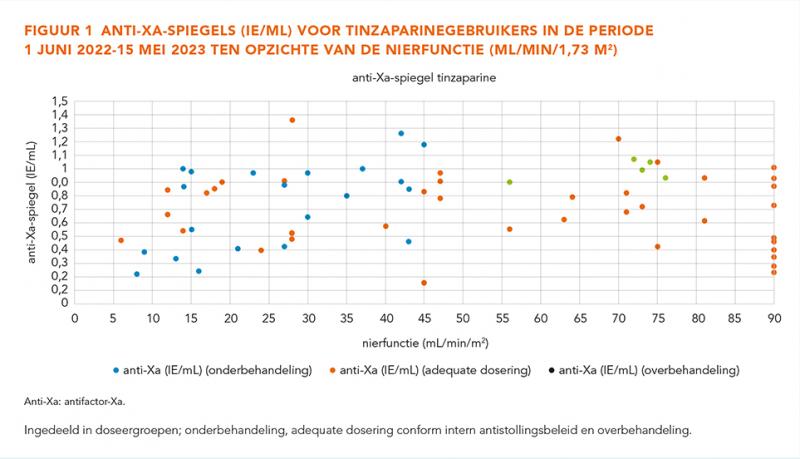
Figuur 1 geeft de anti-Xa-bepalingen van de tinzaparinegebruikers weer ten opzichte van de nierfunctie, met onderscheid tussen de verschillende doseringsgroepen. Er was geen significant verschil in de anti-Xa-spiegel bij patiënten met een eGFR ≤ 30 mL/min/1,73 m2 of CVVH, vergeleken met patiënten met een eGFR > 30 mL/min/1,73 m2 (mediaan 0,64 IE/mL eGFR ≤ 30 mL/min/1,73 m2 of CVVH en mediaan 0,82 IE/mL eGFR > 30 mL/min/1,73 m2; P = 0,124). Opvallend was dat de te lage doseringen met name werden ingezet bij patiënten met een nierfunctie < 50 mL/min/1,73 m2. Verder waren de gemeten anti-Xa-waarden willekeurig verdeeld en was er visueel geen verband te zien tussen de anti-Xa-waarde en de dosering of nierfunctie. Patiënten in de overbehandelingsgroep hadden vaker een nierfunctie > 30 mL/min/1,73 m2, terwijl de patiënten in de onderbehandelingsgroep vaker een nierfunctie ≤ 30 mL/min/1,73 m2 hadden.
Uit statusonderzoek, waarbij de naslag van opnamedagen met tinzaparinebehandeling is gescreend op bloedingen, kwam naar voren dat bij 3 patiënten een bloeding optrad gedurende de tinzaparinebehandeling. Het ging hierbij om ic-patiënten die een intramusculair hematoom in het been (anti-Xa 0,82 IE/mL onder CVVH), een buikwandbloeding (anti-Xa 0,46 IE/mL bij een nierfunctie > 90 mL/min/1,73 m2) en een darmbloeding (anti-Xa 0,35 IE/mL onder CVVH) ontwikkelden, ondanks adequate dosering. De darmbloeding werd waarschijnlijk veroorzaakt door een naad van een eerdere ingreep. Bij 1 patiënt trad tijdens de tinzaparinebehandeling (anti-Xa 0,72 IE/mL) stenttrombose op. Deze patiënt had echter een voorgeschiedenis van hypercholesterolemie en een cerebrovasculair accident (CVA). Alle anti-Xa-spiegels lagen onder de streefwaarden (1,0-2,0 IE/mL) bij adequate dosering tinzaparine.
Om een mogelijk correlatie tussen de tinzaparinedosering en de gemeten anti-Xa-spiegels te onderzoeken, werd de correlatiecoëfficiënt bepaald. Voor de patiënten met een verminderde nierfunctie (≤ 30 mL/min/1,73 m2 of CVVH) was de correlatiecoëfficiënt (R2) 0,062 en voor patiënten zonder verminderde nierfunctie 0,0009. Beide correlatiecoëfficiënten liggen rond de 0, wat suggereert dat er geen duidelijke relatie is tussen de tinzaparinedosering en anti-Xa-spiegels. In de analyse werd echter niet gecorrigeerd voor de dosering en andere variabelen.
Beschouwing
De resultaten van dit beschrijvende onderzoek naar anti-Xa-monitoring bij tinzaparinegebruikers laten zien dat de anti-Xa-spiegels bij alle patiënten, ongeacht de nierfunctie, sterk variabel waren. In geen van de gevallen werd een te hoge anti-Xa-spiegel waargenomen en in het merendeel van de anti-Xa-bepalingen lagen de waarden zelfs onder de streefwaarden (1,0-2,0 IE/mL). Deze bevindingen komen overeen met het onderzoek van Olie et al. [7], waarin werd onderzocht of therapeutisch gedoseerd tinzaparine bij patiënten met nierinsufficiëntie leidt tot adequate anti-Xa-niveaus.
In de dataset viel op dat niet alle patiënten met een adequate dosering werden behandeld en dat in de praktijk ook bij een goede nierfunctie en zonder duidelijke reden anti-Xa-spiegels werden bepaald. Dit betrof met name ic-patiënten. De meeste spiegelbepalingen (61,4%) werden uitgevoerd bij patiënten met een adequate dosering, terwijl bij 31,4% van de bepalingen het ging om onderbehandeling. Opvallend is dat de lage doseringen met name werden ingezet bij patiënten met een nierfunctie < 50 mL/min/1,73 m2. Vóór juni 2022 werd de dosering tinzaparine gereduceerd bij patiënten met een verminderde nierfunctie. De recente beleidswijziging kan verklaren waarom er toch patiënten met een te lage dosering tinzaparine werden behandeld. Het grote aandeel spiegelbepalingen bij patiënten met een therapeutisch lage dosis kan een rol hebben gespeeld in de waargenomen lage anti-Xa-spiegels. Echter valt te betwijfelen of dit de enige oorzaak is, aangezien ook bij patiënten met een adequate behandeling met tinzaparine veel lage anti-Xa-spiegels zijn waargenomen. In enkele gevallen is sprake van overbehandeling (7,1%). Dit wordt verklaard doordat de ziekenhuisapotheker adviseerde de dosering tinzaparine te verhogen bij een te lage anti-Xa-spiegel. De gevonden resultaten suggereren dat accumulatie van tinzaparine bij patiënten met een verminderde nierfunctie minder waarschijnlijk is. Hierbij is nog wel de vraag of anti-Xa-topspiegels wel een goede maat zijn om het risico op accumulatie te bepalen. Hoewel wordt geadviseerd om anti-Xa-topspiegels te meten, lijken anti-Xa-dalspiegels een meer geschikte veiligheids- en werkzaamheidsparameter [6].
Uit statusonderzoek kwam naar voren dat bij 3 patiënten een bloeding optrad gedurende de tinzaparinebehandeling. Dit was echter niet direct te correleren aan het tinzaparinegebruik. Mogelijk spelen andere patiëntgebonden factoren hierbij nog een rol. Een vergelijkbare conclusie werd getrokken in het reviewartikel van Atiq et al. [9], over de profylactische dosering van tinzaparine. Het niet optreden van accumulatie van tinzaparine komt mede doordat tinzaparine een hoog molecuulgewicht heeft, waardoor het in mindere mate renaal wordt geklaard. In het huidige onderzoek werd geen relatie gevonden tussen de dosis tinzaparine en de gemeten anti-Xa-topspiegel. In de analyse is echter niet gecorrigeerd voor de dosering en andere variabelen. In een vervolgonderzoek zou gekeken kunnen worden naar de impact van de dosis op topspiegels in een kinetisch model. Een sterk punt van het onderzoek is dat zowel patiënten met als zonder verminderde nierfunctie zijn meegenomen. Anti-Xa-monitoring wordt in de praktijk vaak toegepast bij zwangeren, patiënten met obesitas en ic-patiënten, waardoor ook patiënten zonder verminderde nierfunctie in de dataset zijn meegenomen. Een beperking van dit onderzoek is dat een deel van patiënten met een verminderde nierfunctie met te lage doseringen werd behandeld, wat kan worden verklaard door een wijziging in het advies op de KNMP Kennisbank op 13 juni 2022. Vóór die tijd werd geadviseerd de dosering tinzaparine te verlagen bij patiënten met een verminderde nierfunctie. Dit advies werd geleidelijk geïmplementeerd in de praktijk. Daarnaast zijn slechts een klein aantal patiënten en anti-Xa-bepalingen uit één ziekenhuis geïncludeerd, wat de generaliseerbaarheid naar andere ziekenhuizen beperkt.
In de huidige landelijke richtlijnen wordt aanbevolen om anti-Xa-monitoring te overwegen bij patiënten met een nierfunctie ≤ 30 mL/min/1,73 m2. De resultaten van dit onderzoek suggereren dat anti-Xa-monitoring bij tinzaparinegebruikers overbodig is. De resultaten dienen echter met voorzichtigheid worden geïnterpreteerd gezien het kleine aantal metingen en het ontbreken van een correctie voor de dosering. Het beperken van onnodige anti-Xa-bepalingen kan niet alleen zorgkosten verlagen, maar ook het ongemak bij patiënten minimaliseren en de werklast voor het personeel verminderen. Het implementeren van een nieuw beleid voor anti-Xa-monitoring kan bijdragen aan een doelmatigere antistollingstherapie.
Conclusie
In dit onderzoek werd een mediane anti-Xa-topspiegel van 0,79 IE/mL gevonden in een kleine groep patiënten die werd behandeld met therapeutisch gedoseerd tinzaparine. De referentiewaarden voor de anti-Xa-topspiegels werden veelal niet gehaald en er werd veel spreiding in de anti-Xa-topspiegels waargenomen. Farmacokinetische modellen zijn nodig om de variatie in anti-Xa-topspiegels te verklaren. Mogelijk kan anti-Xa-topspiegel-monitoring bij gebruik van tinzaparine en verminderde nierfunctie achterwege worden gelaten, mede vanwege het gebrek aan goed onderbouwde referentiewaarden en daarmee onduidelijke behandelconsequenties van dergelijke monitoring.
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. Antitrombotica – Heparinegroep. KNMP Kennisbank [Internet]. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie [geraadpleegd 2023 jul 5].
https://kennisbank.knmp.nl/article/Informatorium_Medicamentorum/G744.html#G54
2. Aantal gebruikers 2018–2022 voor ATC-subgroep B01AB: Heparinegroep. GIPdatabank [Internet]. Diemen: Zorginstituut Nederland [geraadpleegd 2023 jul 5].
https://www.gipdatabank.nl/databank?infotype=g&label=00-totaal&tabel=B_01-basis&geg=gebr&item=B01AB
3. Informatorium Medicamentorum - Tinzaparine. KNMP Kennisbank [Internet]. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie [geraadpleegd 2023 jun 28].
https://kennisbank.knmp.nl/article/Informatorium_Medicamentorum/S2461.html
4. van den Dool EJ, Henskens YMC, Stroobants AK. Anti-factor-Xa-activiteitbepaling voor verschillende heparines, heparinoïde en pentasaccharide. Nederlands tijdschrift voor klinisch chemie en laboratoriumgeneeskunde. 2008 Oct;33(4):244-246.
5. Richtlijn Antitrombotische beleid – Effect LMWH, pentasaccharide of heparinoïde. Nederlandse Internisten Vereniging - Kennisinstituut Federatie Medisch Specialisten. 2016. https://richtlijnendatabase.nl/richtlijn/antitrombotisch_beleid/laboratoriumtesten_bij_antistollingsmiddelen/effect_lmwh_pentasaccharide_of_heparino_de.html
6. van den Broek MPH, Verschueren MV, Knibbe CAJ. Critical appraisal of evidence for anti-Xa monitoring and dosing of low-molecular-weight heparin in renal insufficiency. Expert Rev Clin Pharmacol. 2022 Oct;15(10):1155-1163.
7. Olie RH, Meertens NEL, Henskens YMC, Ten Cate H. Empirically reduced dosages of tinzaparin in patients with moderate-to-severe renal insufficiency lead to inadequate anti-Xa levels. Nephron. 2017;137(2):113-123.
8. Klok FAE, den Exter PL, Bosma M, Eikenboom H. Anti-Xa-activiteit bij laagmoleculairgewicht heparine: wanneer meten en wat te doen met de uitslag? Ned Tijdschr Geneeskd. 2023;167:D7543.
9. Atiq F., van den Bemt PM, Leebeek FW, van Gelder T, Versmissen J. A systematic re-view on the accumulation of prophylactic dosages of low-molecular-weight heparins (LMWHs) in patients with renal insufficiency. Eur J Clinic Pharmacol. 2015 Aug;71(8):921-929.
10. Helfer H, Siguret V, Mahé I. Tinzaparin sodium pharmacokinetics in patients with chron-ic kidney disease: practical implications. Am J Cardiovasc Drugs. 2020 Jun;20(3):223-228.
Referentie
Citeer als: El Allouchi W, van Duijn AL, Heijnen MGM. Mogelijk geen noodzaak voor monitoring anti-Xa-topspiegel bij tinzaparinegebruikers met verminderde nierfunctie. Nederlands Platform voor Farmaceutisch Onderzoek. 2025;10:a1795.
DOI
https://www.knmp.nl/resolveuid/a22ec2be750e4183b3058b66d120934cOpen access

Reactie toevoegen