Een praktische richtlijn voor de indeling en behandeling van overgevoeligheidsreacties bij biologicals
- Rubriek: Overzichtsartikel
- Identificatie: 2025;10:a1793
Kernpunten
- Ongewenste reacties bij biologicals komen frequent voor en worden vaak onterecht geclassificeerd als anafylactische reacties.
- Bij milde infusiereacties hoeft het biological niet te worden vermeden.
- Bij de meeste ongewenste reacties kan de biological na desensibilisatie opnieuw worden gegeven.
- Bij biologicals speelt kruisovergevoeligheid geen rol.
- Goed vastleggen van de overgevoeligheidsreactie en de gewenste voorzorgen bij hernieuwde blootstelling is van cruciaal belang voor veilig gebruik.
Abstract
A practical guideline for the management of adverse drug reactions to biologicals
Background and objective
Biologicals are drugs that are designed to mimic human proteins. Nevertheless, biologicals can cause adverse drug reactions. This literature study examines the types of adverse drug reactions that occur with biologicals, the actions needed to optimise safety of biologicals in case of adverse drug reactions, and how these reactions can be registered in electronic prescribing systems.
Design and methods
Evidence-based information about adverse drug reactions to biologicals was collected by a literature review. Expert opinions were added to include clinical experience and to formulate practice recommendations.
Results
Biologicals may cause adverse drug reactions, which can be diagnosed by phenotype, endotype, and biomarkers. Practice recommendations for the follow-up policy are based on these characteristics and the severity of the symptoms. For most reactions, re-exposure is often possible with premedication, a reduced infusion rate, or desensitisation. However, in cases of severe reactions, re-exposure should be avoided. Since most biologicals have a unique protein structure, cross-reactivity is not expected.
Conclusion
Adverse reactions to biologicals can be diagnosed based on phenotype, endotype, and biomarkers. The follow-up policy is based on the type and severity of the reaction. As there is generally no cross-reactivity, the biological that caused the reaction should be registered as the causative agent in the patient record. Adequate documentation of reactions and the transfer of information between healthcare professionals may further enhance medication safety and assure management of hypersensitivity to biologicals.
Inleiding
In de afgelopen 20 jaar zijn biologicals voor veel aandoeningen onderdeel geworden van het standaard behandelarsenaal.
Biologicals verschillen van chemische geneesmiddelen, met name door de grootte en complexiteit van de eiwitstructuren (zie kader). Het lichaam reageert anders op biologicals en de waargenomen overgevoeligheidsreacties op biologicals zijn deels verschillend [1]. Dit leidt ertoe dat de standaard manier waarop overgevoeligheidsreacties worden vastgesteld en behandeld bij chemische geneesmiddelen, niet toereikend is voor biologicals [2]. Zo worden milde reacties tijdens de infusie niet altijd vastgelegd of niet goed geclassificeerd, waardoor zorgverleners het biological onterecht vermijden en zo de behandelopties van de patiënt beperken. Om dit te voorkomen is een standaard gewenst voor het omgaan met ongewenste reacties van biologicals.
Het doel van dit artikel is inzicht te geven in hoe in de praktijk moet worden omgegaan met overgevoeligheidsreacties op biologicals. Er wordt ingegaan op de farmacologie van deze reacties, de verschillen met chemische geneesmiddelen en kruisovergevoeligheid.
Methoden
De literatuur die is gebruikt voor dit overzichtsartikel is aangedragen door experts in combinatie met literatuur gevonden in PubMed, met de zoektermen ‘drug allergy’, ‘drug hypersensitivity’ en ‘adverse drug reactions’ in combinatie met ‘biologicals’. Overzichtsartikelen over het onderwerp, internationale richtlijnen en relevante artikelen (via citation tracking) werden meegenomen. Tot slot geven we aanbevelingen over hoe te handelen bij ongewenste reacties en hoe deze kunnen worden vastgelegd.
Resultaten
Indeling overgevoeligheidsreacties
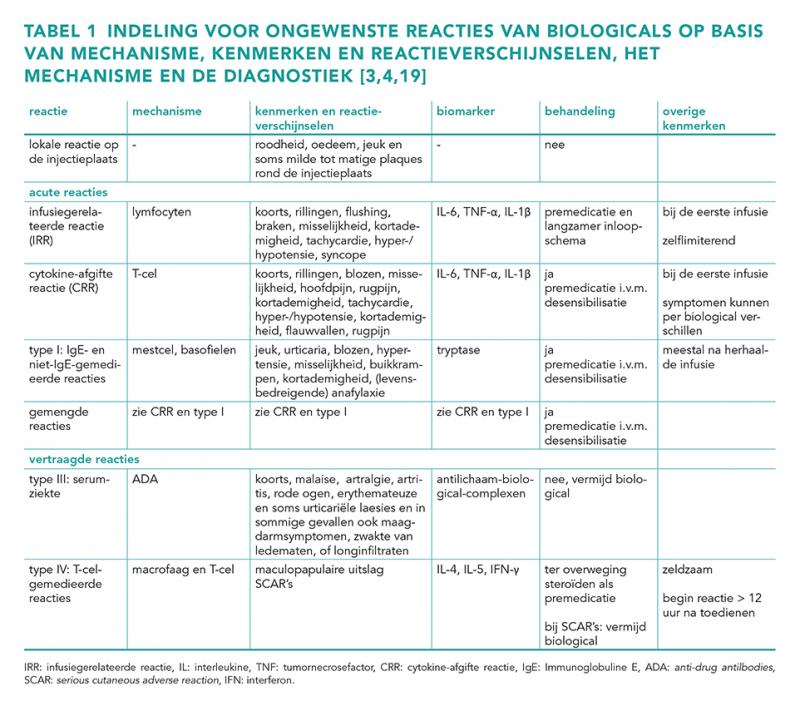
Omdat biologicals in grootte, complexiteit en overgevoeligheidsreacties verschillen van chemische geneesmiddelen, is in 2006 een indeling gemaakt door Pichler om ongewenste reacties te classificeren [2]. In 2021 heeft de European Academy of Allergy and Clinical Immunology (EAACI) op basis van deze indeling en nieuwe inzichten een gecombineerde indeling gemaakt. Hierbij worden reacties onderverdeeld in lokale reacties, acute (directe) reacties en late (vertraagde) reacties. In de praktijk is het vaak moeilijk om op basis van alleen de symptomen onderscheid te maken tussen een infusiegerelateerde reactie, een cytokine-afgifte reactie of type I allergische reactie, omdat een deel van de symptomen niet specifiek is voor een bepaald type reactie en alle acute reacties binnen één uur na toediening optreden. De verschillende types worden hieronder toegelicht [3].
Lokale reacties op de injectieplaats
Lokale reacties op de injectieplaats komen het vaakst voor. Deze reacties treden op binnen 48 uur tijdens of na de infusie. Symptomen zijn erytheem, oedeem, jeuk en soms milde tot matige plaques rond de injectieplaats. De symptomen verdwijnen veelal binnen 1-5 dagen [3,4].
Acute overgevoeligheidsreacties
Infusiegerelateerde reacties
Infusiegerelateerde reacties (IRR’s) komen vaak voor bij de eerste infusie. De ernst van de reactie wordt beïnvloed door de inloopsnelheid. Het onderliggende mechanisme is waarschijnlijk niet-immunologisch. Het klinisch beeld van IRR’s lijkt op type I (IgE- of niet-IgE-gemedieerde reacties) of cytokine-afgifte reacties (zie onder) en zijn mild tot matig qua ernst. De klachten verminderen meestal als de infusiesnelheid wordt verminderd, reageren goed op premedicatie en worden vaak minder bij herhaaldelijke blootstelling [3,4]. IRR’s zijn in het algemeen geen reden om af te zien van behandeling (zie Beleid).
Cytokine-afgifte reacties
Cytokine-afgifte reacties (CRR’s) kenmerken zich door vrijkomen van cytokines als gevolg van een nadelig effect van de toegediende cytokine. Verschillende biologicals kunnen leiden tot het vrijkomen van verschillende cytokines. Binnen 1 tot 2 uur na toediening komen hoge concentraties cytokines vrij, die milde reacties kunnen veroorzaken zoals griepachtige symptomen, jeuk of flushing, maar ook ernstige reacties, zoals multi-orgaanfalen of het cytokine release syndroom (CRS). Deze symptomen verminderen niet na premedicatie of verlaging van de inloopsnelheid, in tegenstelling tot bij IRR’s [3,4].
Type I: IgE- en niet-IgE-gemedieerde reacties
Type I reacties worden veroorzaakt door basofiel- en mestceldegranulatie van vooraf opgeslagen mediatoren zoals histamine en prostaglandine. Dit kan leiden tot urticaria, kortademigheid en (levensbedreigende) anafylaxie [3,4].
Antilichamen tegen geneesmiddelen (anti-drug antibodies, ADA’s) kunnen hierbij een rol spelen. ADA’s binden zich aan een biological en veroorzaken vervolgens een ongewenste reactie. ADA-gemedieerde reacties zijn zowel IgE-gemedieerd (IgE-FcεRI-interactie op mestcellen) als niet-IgE-gemedieerd (IgG-FcγRIII-interactie op basofielen, neutrofielen, macrofagen en immuuncomplex vorming tussen ADA en biological). Dit leidt tot activatie van het complementsysteem, een belangrijk onderdeel van het immuunsysteem dat verantwoordelijk is voor bestrijden van microbiële infecties en de eliminatie van dode lichaamscellen en immuuncomplexen. Een voorbeeld hiervan is complement activatie gerelateerde pseudo-allergie (CARPA) [3,4].
Het onderscheid tussen ADA- en niet-ADA-gemedieerde reacties kan veelal niet gemaakt worden. Symptomen zijn jeuk, urticaria, kortademigheid, hypotensie en anafylaxie. IgE-gemedieerde reacties komen meestal pas voor na herhaalde blootstelling. In sommige gevallen kunnen huidtesten onderscheid maken tussen IgE-gemedieerde of niet-IgE-gemedieerde reacties, maar de rol van huidtesten bij biologicals is op dit moment niet vastgesteld omdat de sensitiviteit en de specificiteit van de huidtest met een biological onbekend zijn [3-6].
Lokale reacties op de injectieplaats komen het vaakst voor. Bij patiënten die een desensibilisatie ondergaan, komen type I reacties het meeste voor. In een retrospectieve studie was dit 63% van de initiële ongewenste reacties [4].
Gemengde reacties
Er is sprake van een gemengde reactie als er symptomen optreden die zowel door cytokine-afgifte als door IgE-gemedieerde reacties kunnen worden veroorzaakt, zoals piepende ademhaling, urticaria, koorts, rillingen of misselijkheid. Bij een gemengde reactie kunnen zowel positieve huidtesten als IgE-testen voor de biological, als verhoogd tryptase of cytokines voorkomen [3,4].
Vertraagde reacties
Serumziekte
Bij een zeldzame type III allergische reactie, ook wel serumziekte of hypersensitivity vasculitis genoemd, worden immuuncomplexen gevormd tussen antilichamen van klasse IgG of IgM tegen geneesmiddelen (ADA) en de biological. Deze immuuncomplexvorming leidt tot complementactivatie, wat de ontstekingsreactie versterkt. Symptomen die optreden bij serumziekte zijn onder andere koorts, malaise, vasculitis glomerulonephritis, artritis en in sommige gevallen ook maagdarmklachten, zwakte in de ledematen of longinfiltraten. De diagnose wordt gesteld op basis van de klinische symptomen, waarbij laboratoriumonderzoek dit ondersteunt. Mogelijke bevindingen zijn verhoogde inflammatieparameters, neutropenie, een reactieve lymfocytose, milde eosinofilie, trombocytopenie, complementverbruik en proteïnurie [7]. Mogelijk kunnen corticosteroïden helpen [3,4].
T-cel-gemedieerde reacties (type IV)
Vertraagde type IV reacties worden veroorzaakt door activatie van T-cellen en ontstaan meestal meer dan 12 uur tot enkele weken na toediening. Symptomen lopen uiteen van niet-ernstige maculopapuleus exantheem (MPE) tot zeldzame ernstige cutane reacties (Sever Cutaneous Adverse Reaction [SCAR]), die worden gekenmerkt door een combinatie van bepaalde huidsymptomen (onder andere MPE, pustels en blaren) en aanwezigheid van alarmsymptomen (‘danger signs’). Alarmsymptomen zijn bepaalde afwijkingen bij lichamelijk en laboratoriumonderzoek die wijzen op orgaanbetrokkenheid. Bij bepaalde combinaties van huidbeeld en alarmsymptomen kan sprake zijn van bijvoorbeeld het Stevens-Johnson syndroom (SJS) of acute gegeneraliseerde exanthemateuze pustulose (AGEP) [2-5,8].
Hulpstoffen
De meeste hulpstoffen leiden niet tot overgevoeligheidsreacties. Er zijn echter enkele hulpstoffen in preparaten met biologicals die IgE-gemedieerde of niet-IgE-gemedieerde anafylactische reacties kunnen uitlokken. Voorbeelden hiervan zijn carboxymethylcellulose, galactose-alfa-1,3 en polysorbaat 80. Omdat deze hulpstoffen ook in cosmetica en andere medicatie worden gebruikt, kunnen patiënten al gesensibiliseerd zijn vóór de eerste toediening van een biological in een andere toedieningsvorm [9-11]. In dergelijke gevallen is sprake van een overgevoeligheid voor de hulpstof en niet voor de biological zelf.
Kruisovergevoeligheid
Bij chemische geneesmiddelen kan kruisovergevoeligheid op basis van antistoffen tussen structureel verwante geneesmiddelen voorkomen. Het immuunsysteem herkent een bepaald deel van het geneesmiddel (epitoop) en ontwikkelt daar antilichamen tegen. Geneesmiddelen die structureel sterk op elkaar lijken, kunnen dezelfde epitopen hebben. Het immuunsysteem kan dan geen onderscheid maken tussen deze geneesmiddelen. Bij een overgevoeligheid worden daarom bij voorkeur ook middelen waarvan kruisreacties bekend zijn vermeden [12]. Biologicals zijn grote complexe eiwitten met een unieke eiwitstructuur. Omdat er alleen sprake kan zijn van kruisovergevoeligheid als de bindingsepitopen op het eiwit gelijk zijn, is het onwaarschijnlijk dat kruisreacties zullen optreden bij verschillende biologicals. Tot nu toe is het bewijs omtrent kruisovergevoeligheid bij biologicals minimaal. Zo zijn patiënten met ernstige infusiereacties door het anti-EGFR-antilichaam cetuximab succesvol behandeld met het andere anti-EGFR-antilichaam panitumumab [13]. Ook bij een overgevoeligheidsreactie op een TNF-α-remmer op basis van IgG-antistoffen kan succesvol worden geswitcht naar een ander TNF-α-remmer zonder kruisovergevoeligheid [14]. Indien sprake is van een overgevoeligheid voor een hulpstof zoals polysorbaat 80, kan wel een overgevoeligheidsreactie optreden bij twee verschillende biologicals. Er is dan geen sprake van kruisovergevoeligheid tussen biologicals, maar een overgevoeligheid voor een identieke hulpstof [9-11].
Biosimilars
Biosimilars zijn biologische geneesmiddelen met hetzelfde aangrijpingspunt als een al bestaand biological (het referentieproduct). De eiwitstructuur van een biosimilar kan echter verschillen. Uiteindelijk moet de kwaliteit, veiligheid en effectiviteit van de biosimilar vergelijkbaar zijn aan het referentieproduct, en worden verschillen tussen het referentieproduct en de biosimilar als niet-klinisch relevant beschouwd. Een naïeve patiënt kan daarom probleemloos beginnen met een biosimilar [15-17].
Onder zorgverleners en patiënten bestaan zorgen over het switchen van een referentieproduct naar een biosimilar. Deze zorgen komen doordat switchen zou kunnen leiden tot een grotere kans op overgevoeligheid, omdat de biosimilar dezelfde epitopen kan bevatten. Zo bleek uit klinische studies dat neutraliserende antilichamen tegen infliximab ook de biosimilar konden neutraliseren [15]. Of dit ook geldt voor overgevoeligheidsreacties is tot nog toe niet waargenomen in klinische studies. Een expertgroep vanuit het Europees Medicijn Agentschap (EMA) heeft beoordeeld dat switchen tussen biosimilars veilig is [15-17]. Wanneer echter sprake is van een bewezen ernstige ongewenste reactie, is het ongewenst om de patiënt bloot te stellen aan dit middel, inclusief biosimilars.
Diagnose
In de praktijk is het onderscheid tussen verschillende type reacties moeilijk te maken; er is namelijk een grote overlap in de symptomen en bij acute reacties ook in het tijdsbeloop. Daarnaast zijn er geen diagnostische testen beschikbaar. Ook is de voorspellende waarde van huidtesten bij biologicals gering [6,12].
Omdat diagnostische testen ontoereikend zijn, worden overgevoeligheidsreacties ingedeeld op basis van de reactie, het mechanisme, de kenmerken en de reactieverschijnselen (zie tabel 1). Onder biomarkers vallen onder
andere tryptase en cytokines, maar ook huidtesten. Het meten van biomarkers zoals tryptase of IL-6 zou een idee kunnen geven wat voor soort reactie is opgetreden en wordt momenteel onderzocht. Deze testen zijn echter nog niet gevalideerd [3,4].
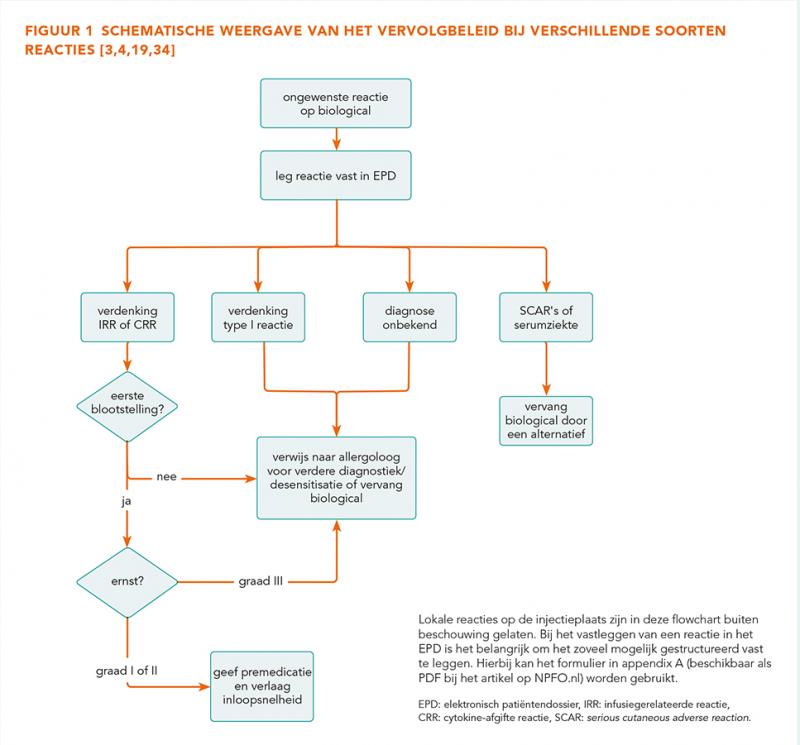
Na het optreden van een ongewenste reactie zal moeten worden bepaald wat het vervolgbeleid wordt. Hierbij kan gebruik worden gemaakt van de kenmerken en reactieverschijnselen, het mechanisme, de diagnostiek en de beschikbaarheid van alternatieven. Voor het diagnosticeren en bepalen van het vervolgbeleid dient de expertise van een allergoloog en/of immunoloog te worden geraadpleegd [3,4].
Beleid
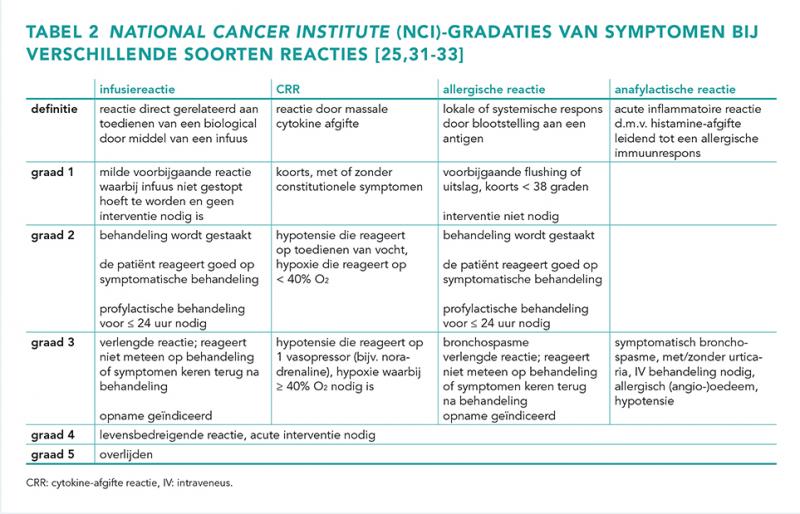
Het vervolgbeleid hangt af van de symptomen en de ernst van de reactie die is opgetreden. Zie tabel 2 voor een indeling van de symptomen, de ernst en het beleid. Als er sprake is van een IRR dan wordt gekozen voor premedicatie in combinatie met een langzamer inloopschema, zonder dat desensibilisatie nodig is [3,4,18]. In de praktijk is er geen gestandaardiseerd advies over hoeveel de inloopsnelheid kan worden verlaagd. Sommige studies adviseren om het infuus te herstarten met een gehalveerde inloopsnelheid of terug te gaan naar de inloopsnelheid waarmee het biological eerder wel werd verdragen. Als dat goed gaat, kan de inloopsnelheid weer worden verhoogd [19-22].
Bij een CRR wordt gekozen voor premedicatie en desensibilisatie. Bij een type I reactie en ernstige (type III) reacties zoals serumziekte en SCAR’s dient het biological te worden vermeden. Bij zeldzame (type IV) reacties wordt het beleid per situatie nader bepaald. In figuur 1 wordt het beleid na optreden van een overgevoeligheidsreactie weergegeven. Bij patiënten die overgevoelig zijn voor een bepaald middel, kunnen reacties ontstaan onafhankelijk van de toedieningsweg waarbij reacties na intraveneuze toediening vaak sneller optreden [23]. Het is mogelijk dat lokale toepassing soms wel wordt verdragen zonder overgevoeligheidsreacties [24,25]. In de literatuur zijn geen gevallen beschreven waarbij het switchen van systemische toediening naar subcutane toediening (of vice versa) overgevoeligheidsreacties kunnen worden voorkomen [26]. Daarom wordt switchen van toedieningsvorm bij een ernstige reactie niet aangeraden.
Premedicatie
Premedicatie wordt gebruikt om ongewenste reacties te onderdrukken, in combinatie met een lagere inloopsnelheid bij infusiegerelateerde reacties of met een desensibilisatieschema. Middelen die als premedicatie worden gegeven, zijn H1- en H2-antagonisten en corticosteroïden [4,23]. Bij desensibilisatie kunnen ook de volgende middelen worden gegeven: acetylsalicylzuur tegen flushing, montelukast/salbutamol tegen bronchospasme, ondansetron tegen misselijkheid en paracetamol, NSAID’s en opiaten tegen pijn en koorts. Daarnaast worden ook gabapentine en lorazepam incidenteel gegeven [27].
Methotrexaat of een andere DMARD (disease modifying antirheumatic drug) wordt soms bij auto-inflammatoire aandoeningen en auto-immuunziekten gegeven in een poging om IgG-antistofvorming te onderdrukken [10]. Lokale infusiereacties komen minder voor bij gelijktijdig gebruik van immunosuppressieve medicatie, zoals methotrexaat of een lage dosis corticosteroïden [8].
Daarnaast kan bij CRR het toedienen van zoutoplossing tijdens de infusie leiden tot een minder ernstige reactie. Verondersteld wordt dat dit komt door de verdunning van antigenen en andere mediatoren door het grotere volume. Hierdoor worden ontstekingsmediatoren ook sneller afgevoerd. Tijdens een reactie kan tot 500 mL/uur gegeven worden totdat de symptomen zijn verdwenen [4].
Desensibilisatie
Desensibilisatie kan worden overwogen als er geen goed alternatief beschikbaar is voor de biological. Met een succesvolle desensibilisatie kunnen patiënten namelijk op dezelfde behandeling blijven [28]. Succesvolle desensibilisaties zijn bij zowel type I reacties als bij CRR’s, gemengde reacties en type IV reacties gedaan [4]. Voor sommige biologicals zijn versnelde desensibilisatieprotocollen beschikbaar [6]. De overweging voor desensibilisatie hangt af van ernst van de reactie. Bij ernstige vertraagde reacties, zoals SCAR’s of serumziekte, is desensibilisatie gecontra-indiceerd. Er is succesvolle desensibilisatie gemeld bij adalimumab, infliximab, rituximab en trastuzumab [9-11,13,29,30]. Bij 13,5-23% van de patiënten treedt na desensibilisatie toch een reactie op [4].
Voorbeelden
Rituximab
Door binding van rituximab aan CD20 op lymfocyten, gaan de lymfocyten kapot en geven ze cytokines af. Acute ongewenste reacties komen voor bij 5-10% van de behandelingen [3]. De meeste reacties die optreden zijn type I reacties en ontstaan in de eerste twee uur van de eerste behandeling en zijn over het algemeen mild. Symptomen kunnen hoofdpijn, koorts, zweten, rillen, milde hypotensie, misselijkheid, rugpijn of angio-oedeem omvatten [4]. Ongeveer 12% van deze reacties is ernstig. Zo kunnen symptomen van het tumorlysissyndroom of CRS optreden. Patiënten met grote hoeveelheden lymfocyten hebben een groter risico op ernstige infusiereacties zoals CRS. De inloopsnelheid moet bij deze patiënten worden verlaagd, of de dosis moet over twee dagen worden verdeeld [20,31-33].
Checkpointremmers
Bij checkpointremmers wordt bij 25% van de patiënten infusiereacties gezien, waarbij type I reacties het meest voorkomen. Slechts bij 2% van de patiënten treedt een ernstige infusiereactie op (graad 4). Patiënten die een ernstige reactie hadden en last kregen van een opgezette keel, kortademigheid of lage saturatie, konden na desensibilisatie succesvol opnieuw worden behandeld met checkpointremmers. Uit een retrospectieve studie bleek dat ongewenste reacties bij ipilimumab vaker voorkomen bij vervolginfusies, wat kan duiden op een immunologische component. Ook bij checkpointremmers is het beleid om preventief premedicatie te geven bij de eerste giften van de behandeling met paracetamol en antihistaminica. Checkpointremmers staan erom bekend dat zij door hun directe werking op het immuunsysteem ook immunotoxiciteit kunnen veroorzaken. Voorbeelden van immunotoxiciteit zijn longontsteking, levertoxiciteit of schildklieraandoeningen [34].
Vastleggen van ongewenste reacties
Voor het vervolgbeleid is het cruciaal om elke ongewenste reactie vast te leggen in het patiëntendossier. Hierbij zijn de registratie van het toegediende middel, het tijdsbeloop, de symptomen en de te ondernemen acties van belang. Een ongewenste reactie wordt vastgelegd per individueel middel, dat wil zeggen de (generieke) stof die de reactie heeft veroorzaakt. In appendix A (beschikbaar als PDF onderaan dit artikel, sectie Downloads) is een voorbeeldformulier toegevoegd voor het vastleggen van een ongewenste reactie met de gegevens die volgens de auteurs van deze bijdrage relevant zijn.
Beschouwing
Biologicals hebben een zeer specifieke werking in het lichaam. Daarnaast interfereren ze met onderdelen van het verworven of aangeboren immuunsysteem. Dit leidt ertoe dat biologicals unieke reacties kunnen veroorzaken, zoals een CRR, die bij andere geneesmiddelen niet voorkomen.
Ongewenste reacties door biologicals verschillen op een aantal vlakken ten opzichte van chemische geneesmiddelen. Allereerst is bij biologicals geen sprake van kruisreactiviteit. Daarnaast is het vaak moeilijk om de verschillende typen reacties te onderscheiden.
De grote overlap in symptomen maakt dat het onderscheid in type reactie niet altijd gemaakt kan worden, waardoor klinische ervaring in het omgaan met reacties hierbij van groot belang is in de praktijk. Daarom sluit een indeling op basis van de reactie, het mechanisme, de kenmerken en de reactieverschijnselen op dit moment het beste aan bij de praktijk.
Een biological hoeft niet altijd vermeden te worden na het optreden van een ongewenste reactie. De meeste IRR’s kunnen verminderd worden door middel van premedicatie of het verlagen van de inloopsnelheid. Bij type I, CRR en type IV reacties moet de biological in eerste instantie worden vermeden en kan na succesvolle desensibilisatie opnieuw worden toegediend. Het onderscheid tussen een CRR, een IgE- of niet-IgE-gemedieerde type I reactie of gemengde reactie is niet van groot belang, omdat in alle gevallen desensibilisatie een zinvolle behandeling kan zijn. Bij SCAR’s en serumziekte is desensibilisatie echter gecontra-indiceerd. Een overgevoeligheidsreactie door een biological dient te allen tijde te worden vastgelegd in het elektronisch patiëntendossier. Hierbij zijn details over de oorzaak, symptomen en ondernomen acties belangrijk.
Conclusie
Dit artikel geeft een overzicht van de indeling van overgevoeligheidsreacties bij biologicals. Omdat het in de praktijk vaak moeilijk is om de verschillende soorten reacties te onderscheiden, wordt het vervolgbeleid gebaseerd op de reactie, het mechanisme, de kenmerken en de reactieverschijnselen. Om ongewenste reacties bij een vervolgblootstelling te voorkomen, zijn een goede anamnese, vastlegging en uitwisseling van overgevoeligheden voor biologicals van groot belang.
Downloads
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. de Vrind JAW, Lagas JS, Jessurun N, et al. Overgevoeligheidsreacties bij geneesmiddelgebruik: eenduidig vastleggen en overdragen naar andere zorgverleners. Pharmaceutisch Weekblad Wetenschappelijk Platform 9:a1544. 2015;9:a1544.
2. Pichler WJ. Adverse side-effects to biological agents. Allergy. 2006 Aug;61(8):912-20.
3. Bavbek S, Pagani M, Alvarez-Cuesta E, et al. Hypersensitivity reactions to biologicals: An EAACI position paper. Allergy. 2022 Jan;77(1):39-54.
4. Isabwe GAC, Garcia Neuer M, de las Vecillas Sanchez L, Lynch DM, Marquis K, Castells M. Hypersensitivity reactions to therapeutic monoclonal antibodies: Phenotypes and endotypes. J Allergy Clin Immunol. 2018 Jul;142(1):159-170.e2.
5. Puxeddu I, Giori L, Rocchi V, et al. Hypersensitivity reactions during treatment with infliximab, etanercept, and adalimumab. Ann Allergy Asthma Immunol. 2012 Feb;108(2):123-4.
6. Khan DA. Hypersensitivity and immunologic reactions to biologics: opportunities for the allergist. Ann Allergy Asthma Immunol. 2016 Aug;117(2):115-20.
7. Wener MH. Serum sickness and serum sickness-like reactions, 2022 [Internet]. In Adkinson NF, Feldweg AM (Eds.), UptoDate [geraadpleegd 2024 mei 22].
https://www.uptodate.com/contents/serum-sickness-and-serum-sickness-like-reactions
8. Richtlijn Biologicals - Preventie en behandeling van allergische reacties als bijwerking van biologicals, versie 01-01-2011. [Internet]. Utrecht: Federatie Medisch Specialisten (FMS) - Nederlandse Vereniging voor Reumatologie (NVR). Richtlijnendatabase [geraadpleegd 2024 jan 30].
https://richtlijnendatabase.nl/richtlijn/biologicals/bijwerkingen_van_biologicals/allergische_reacties_bijwerking_biologicals.html
9. Hausmann OV, Seitz M, Villiger PM, Pichler WJ. The complex clinical picture of side effects to biologicals. Med Clin North Am. 2010 Jul;94(4):791-804, xi-ii.
10. Scherer K, Spoerl D, Bircher AJ. Adverse drug reactions to biologics. J Dtsch Dermatol Ges. 2010 Jun;8(6):411-26.
11. Vultaggio A, Maggi E, Matucci A. Immediate adverse reactions to biologicals: from pathogenic mechanisms to prophylactic management. Curr Opin Allergy Clin Immunol. 2011 Jun;11(3):262-8.
12. Commentaren Medicatiebewaking: Overgevoeligheden – Algemeen [Internet]. Houten: Stichting Health Base [geraadpleegd 2024 jan 30].
https://www.commentarenmedicatiebewaking.nl/health-base/inhoudsopgave/overgevoeligheden-ov/overgevoeligheden-algemeen/
13. UpToDate Lexidrug, Monoclonal antibody allergy [Internet]. Lexi-Drugs Online. Waltham, MA: UpToDate, Inc [geraadpleegd 2024 jan 30].
https://online.lexi.com.
14. Bendtzen K. Tumor necrosis factor-alpha inhibitors: Induction of antibodies, autoantibodies, and autoimmune diseases - UpToDate.
15. Barbier L, Ebbers HC, Declerck P, Simoens S, Vulto AG, Huys I. The Efficacy, Safety, and Immunogenicity of Switching Between Reference Biopharmaceuticals and Biosimilars: A Systematic Review. Clin Pharmacol Ther. 2020 Oct;108(4):734-755.
16. Kurki P, van Aerts L, Wolff-Holz E, Giezen T, Skibeli V, Weise M. Interchangeability of Biosimilars: A European Perspective. BioDrugs. 2017 Apr;31(2):83-91.
17. European Medicines Agency and the European Commission. Biosimilars in the EU - Information guide for healthcare professionals [Internet].
https://www.ema.europa.eu/en/documents/leaflet/biosimilars-eu-information-guide-healthcare-professionals_en.pdf
18. Yang BC, Castells MC. The Who, What, Where, When, Why, and How of Drug Desensitization. Immunol Allergy Clin North Am. 2022;42(2):403-420. doi:10.1016/J.IAC.2021.12.004
19. Yang BC, Castells MC. The Who, What, Where, When, Why, and How of Drug Desensitization. Immunol Allergy Clin North Am. 2022 May;42(2):403-420.
20. Rombouts MD, Swart EL, Van Den Eertwegh AJM, Crul M. Systematic Review on Infusion Reactions to and Infusion Rate of Monoclonal Antibodies Used in Cancer Treatment. Anticancer Res. 2020 Mar;40(3):1201-1218.
21. Doessegger L, Banholzer ML. Clinical development methodology for infusion-related reactions with monoclonal antibodies. Clin Transl Immunology. 2015 Jul 17;4(7):e39.
22. Thompson LM, Eckmann K, Boster BL, et al. Incidence, Risk Factors, and Management of Infusion-Related Reactions in Breast Cancer Patients Receiving Trastuzumab. Oncologist. 2014 Mar;19(3):228-34.
23. Barroso A, Estevinho F, Hespanhol V, Teixeira E, Ramalho-Carvalho J, Araújo A. Management of infusion-related reactions in cancer therapy: strategies and challenges. ESMO Open. 2024 Mar;9(3):102922.
24. Torres MJ, Blanca M, Fernandez J, et al. Selective allergic reaction to oral cloxacillin. Clini Exp Allergy. 1996 Jan;26(1):108-11.
25. Jonaitis L, Marković S, Farkas K, et al. Intravenous versus subcutaneous delivery of biotherapeutics in IBD: an expert’s and patient’s perspective. BMC Proc. 2021;15(Suppl 17):25.
26. Bittner B, Richter W, Schmidt J. Subcutaneous Administration of Biotherapeutics: An Overview of Current Challenges and Opportunities. Biodrugs. 2018 Oct;32(5):425-440.
27. Yang JM, Koh HY, Moon SY, et al. Allergic disorders and susceptibility to and severity of COVID-19: A nationwide cohort study. J Allergy Clin Immunol. 2020 Oct;146(4):790-798.
28. Alvarez-Cuesta E, Madrigal-Burgaleta R, Broyles AD, et al. Standards for practical intravenous rapid drug desensitization & delabeling: A WAO committee statement. World Allergy Organ J. 2022 May;15(6):100640.
29.Patel S V., Khan DA. Adverse Reactions to Biologic Therapy. Immunol Allergy Clin North Am. 2017 May;37(2):397-412.
30. Waldron JL, Schworer SA, Kwan M. Hypersensitivity and Immune-related Adverse Events in Biologic Therapy. Clin Rev Allergy Immunol. 2022 Jun;62(3):413-431.
31. Roselló S, Blasco I, Garća Fabregat L, Cervantes A, Jordan K; ESMO Guidelines Committee. Management of infusion reactions to systemic anticancer therapy: ESMO Clinical Practice Guidelines. Ann Oncol. 2017 Jul 1;28(suppl_4):iv100-iv118.
32. UpToDate MJ Leandro. Rituximab: Principles of use and adverse effects in rheumatoid arthritis. In: UpToDate, Connor RF (Ed), Wolters Kluwer [laatst geraadpleegd 2024 jan 30].
33. Broyles AD, Banerji A, Barmettler S, et al. Practical Guidance for the Evaluation and Management of Drug Hypersensitivity: Specific Drugs. J Allergy Clin Immunol Pract. 2020 Oct;8(9S):S16-S116.
34. Fessas P, Possamai LA, Clark J, et al. Immunotoxicity from checkpoint inhibitor therapy: clinical features and underlying mechanisms. Immunology. 2020 Feb;159(2):167-177.
35. College ter Beoordeling van Geneesmiddelen (CBG). Vragen en antwoorden over biologische geneesmiddelen [Internet]. Utrecht: College ter Beoordeling van Geneesmiddelen, maart 2016.
https://www.medicijngebruik.nl/content/userfiles/files/cbg-a5-brochure-biologische-geneesmiddelen-uitgebreid-lr.pdf
36. Vasbinder R. Monoklonale antilichamen [Internet]. Gebu. 2008;42(2):13-16 [geraadpleegd 2024 jan 30].
https://www.ge-bu.nl/artikel/monoklonale-antilichamen
Referentie
Citeer als: De Ruiter E, van Maaren M, Harmane R, Rombach S, van Daele P, Wasylewicz A, Borgsteede S. Een praktische richtlijn voor de indeling en behandeling van overgevoeligheidsreacties bij biologicals. Nederlands Platform voor Farmaceutisch Onderzoek. 2025;10:a1793.
DOI
https://www.knmp.nl/resolveuid/ae93131baeef4177b08a8262a3efc429Open access


Reactie toevoegen