De efficiëntie van klassieke medicatiebewakingssignalen en clinical rules vanuit het perspectief van een apotheker in een Nederlandse ziekenhuisapotheek
- Rubriek: Oorspronkelijk artikel
- Identificatie: 2025;10:a1792
Kernpunten
- Slechts 0,9% van de klassieke medicatiebewakingssignalen leidt tot een contactmoment tussen arts en apotheker, terwijl hier dagelijks ongeveer 4 uur aan wordt besteed.
- Bij clinical rules is de signaalefficiëntie beter dan bij klassieke medicatiebewaking, maar nog steeds redelijk laag; dit is 18,9% in deze setting.
- Voor een efficiëntere medicatiebewaking zijn optimalisatie van de technische mogelijkheden van het elektronisch patiëntendossier (EPD) en een andere manier van medicatiebewaking, zoals een verlengde-armconstructie, wenselijk.
Abstract
Evaluation of the efficacy of conventional medication surveillance and clinical rules from a pharmacist’s perspective in daily hospital practice
Background
Alert fatigue is probably one of the biggest downsides of medication monitoring systems used in current daily (hospital) practice. Studies suggest that only 1.4-7.5% of conventional medication surveillance signals require intervention by a pharmacist, while intervention rates of 80-94% are possible for clinical rules.
Objective
The objective is to determine the current extent of alert fatigue by calculating the positive predictive value (PPV) for consultations between pharmacist and physician. This is done for both conventional medication surveillance and clinical rules at the hospital pharmacy of Maasstad Hospital.
Design
A retrospective observational study.
Methods
Data from January 2022 were analyzed retrospectively. This data contained all conventional medication surveillance signals, clinical rules, and interventions during the study period. Signal frequency and the number of consultations per signal were determined, leading to a PPV for consultation, which is the primary outcome of this study. The secondary outcome is the number of advices that resulted in a medication change.
Results
A total of 15,016 conventional medication surveillance signals and 1,544 clinical rules were generated. Of these, 0.9% of conventional medication surveillance signals and 18.9% of clinical rules led to a consultation between pharmacist and physician. For conventional medication surveillance signals, 83 of 132 advices (62.9%) were followed, while for clinical rules, 165 out of 260 advices (63.5%) were followed by the physician.
Conclusion
The PPV of conventional medication surveillance is very low and introduces the risk of alert fatigue as only 9 out of 1,000 signals lead to a consultation between pharmacist and physician. Although the PPV of clinical rules is higher, it is still lower than desired. There is room for improvement of both types of medication surveillance.
Inleiding
Eén van de grote problemen binnen de huidige medicatiebewaking in de apotheek is signaalmoeheid. Bij signaalmoeheid ontstaat het risico dat relevante signalen worden gemist door het grote aantal irrelevante signalen dat wordt verwerkt. Bij ongeveer 1 op de 100 voorschriften voert een apotheker een wijziging door om een farmacotherapiegerelateerd probleem op te lossen dat via medicatiebewaking is gesignaleerd. In 50% van de gewijzigde voorschriften voorkomt de apotheker hiermee schade of ongemak en draagt bij aan de effectiviteit van het geneesmiddel [1]. Daartegenover staat dat ongeveer 81% van de tijd die ziekenhuisapothekers besteden aan medicatiebewaking, wordt besteed aan irrelevante signalen [2]. Apothekers beschouwen 62% van de signalen als onbehulpzaam, 50% als onbelangrijk en 21% als frustrerend [3].
Binnen de ziekenhuisapotheek van het Maasstad Ziekenhuis wordt gebruik gemaakt van twee typen medicatiebewaking. Dit zijn de klassieke medicatiebewaking gebaseerd op de G-Standaard en medicatiebewaking door middel van clinical rules. De apothekersassistent parafeert elke medicatieopdracht. Op basis van deze medicatieopdrachten vindt medicatiebewaking via de klassieke medicatiebewaking plaats. Een groot aandeel van de klassieke medicatiebewakingssignalen wordt direct inhoudelijk door de apothekersassistent afgehandeld. Voorbeelden hiervan zijn veelvoorkomende geneesmiddelinteracties, waaronder tijdsinteracties en dubbelmedicatiemeldingen. Hiervoor zijn afhandelprotocollen beschikbaar. Het geprotocolleerd afhandelen van bewakingssignalen door de apothekersassistent is ook wel bekend als de verlengde-armconstructie. In sommige gevallen is de uitkomst van een afhandelprotocol dat de beoordeling moet worden gedaan door een apotheker. De apotheker parafeert vervolgens alle medicatieopdrachten met minimaal één relevant signaal. De apotheker controleert dus ook de vele signalen die al zijn beoordeeld en afgehandeld door de apothekersassistent conform de KNMP-richtlijn Ter hand stellen [4]. Daarnaast beoordeelt de apotheker de overige signalen die apothekersassistenten niet zelfstandig mogen of kunnen afhandelen. De apotheker verwerkt ook dagelijks de gegenereerde clinical rules. Wanneer een medicatiebewakingssignaal of clinical rule leidt tot een contactmoment met de voorschrijver, dan legt de apotheker dit vast met behulp van een Interventie Consultatie Registratie (ICR) in het elektronisch patiëntendossier (EPD). Dit is een communicatiemiddel binnen het gehele apotheekteam. Bovenstaand proces is samengevat in figuur 1.
Beide systemen genereren veel signalen op een dag, maar deze signalen zijn niet allemaal even relevant. Verschillende onderzoeken tonen aan dat maar 1,4-7,5% van de klassieke medicatiebewakingssignalen leidt tot interventie door een apotheker [2,5-7]. Bij clinical rules zijn hogere percentages haalbaar, namelijk 80-94% [8,9]. Deze percentages zijn behaald na optimalisatie van de betreffende clinical rules door de clinical rules te testen in de praktijk.
De afgelopen jaren zijn binnen de ziekenhuisapotheek van het Maasstad Ziekenhuis aanpassingen gedaan om de medicatiebewaking stapsgewijs te optimaliseren. Dit omvat het onderdrukken van een aantal signalen binnen het standaardpakket van HiX en het laten afhandelen van een aantal veelvoorkomende signalen, waaronder geneesmiddelinteracties en dubbelmedicatiemeldingen, door apothekersassistenten. HiX is het EPD en voorschrijfsysteem dat binnen het Maasstad Ziekenhuis wordt gebruikt.
Het doel van dit onderzoek was om de huidige signaalmoeheid na het doorvoeren van de eerste verbeterstappen in kaart te brengen binnen de ziekenhuisapotheek van het Maasstad Ziekenhuis. Hierdoor kan het effect van bovengenoemde verbetering op de praktijk worden geëvalueerd. De huidige signaalmoeheid is onderzocht met behulp van de positief voorspellende waarde (PVW) voor een (telefonisch) contactmoment met de voorschrijver. Verder is onderzocht of contactmomenten door de apotheker op basis van klassieke medicatiebewaking en clinical rules leidden tot een medicatiewijziging.
Methoden
Het betreft een retrospectief onderzoek uitgevoerd binnen de ziekenhuisapotheek van het Maasstad Ziekenhuis. In dit onderzoek zijn data afkomstig uit het EPD van januari 2022 bestudeerd. De verzamelde data bevatten alle gegenereerde klassieke medicatiebewakingssignalen (doseringsmeldingen, dubbelmedicatie, interacties, contra-indicaties en overgevoeligheden), clinical rules en ICR’s van januari 2022. De inhoud van de clinical rules is samengevat in appendix A (beschikbaar als PDF onderaan dit artikel, sectie Downloads).
De data zijn afkomstig van klinische patiënten van alle afdelingen, met uitzondering van de intensive care (IC). Voor IC-patiënten wordt namelijk een ander EPD gebruikt. Alleen de klassieke medicatiebewakingssignalen die door een apotheker worden beoordeeld tijdens het paraferen, zijn geïncludeerd. Het aantal signalen dat artsen bij het voorschrijven te zien krijgen, en de afhandeling hiervan, is niet onderzocht. Artsen krijgen signalen met een lagere relevantiegraad (en dus meer signalen) te zien dan apothekers. Onderstaande signalen worden niet beoordeeld door de apotheker en zijn dus geëxcludeerd:
- klassieke medicatiebewakingssignalen die binnen de G-Standaard zijn aangemerkt als niet relevant;
- geneesmiddelinteracties die binnen de ziekenhuisapotheek van het Maasstad Ziekenhuis aangemerkt zijn als niet relevant voor de klinische setting (appendix B, beschikbaar als PDF onderaan dit artikel, sectie Downloads);
- geneesmiddelinteracties die onderdrukt zijn binnen de ziekenhuisapotheek van het Maasstad Ziekenhuis doordat deze al gedekt zijn met clinical rules;
- medicatiebewakingssignalen gebaseerd op ad hoc toedieningen (geen beoordeling doordat eenmalige toediening reeds heeft plaatsgevonden bij het zien van het signaal).
Na exclusie van bovengenoemde signalen is de frequentie van de klassieke medicatiebewakingssignalen en clinical rules bepaald. Vervolgens is van alle ICR’s nagegaan of er sprake was van een (telefonisch) contactmoment met de voorschrijver gebaseerd op medicatiebewaking.
De primaire uitkomstmaat is bepaald aan de hand van het aantal contactmomenten per medicatiebewakingssignaal en clinical rule. Dit wordt uitgedrukt als de PVW voor een contactmoment, berekend met de formule: PVW = (aantal contactmomenten / aantal signalen) * 100%. De PVW is het percentage signalen dat tot een contactmoment met de voorschrijver door de apotheker leidt. Doordat ICR’s uitsluitend door apothekers worden aangemaakt, is de PVW voor een contactmoment vanuit het perspectief van de apotheker bepaald. De PVW is een gangbare uitkomstmaat bij vergelijkbare studies naar signaalefficiëntie.
De secundaire uitkomstmaat is het aantal adviezen dat heeft geleid tot een medicatiewijziging. Dit is handmatig met behulp van het EPD per contactmoment onderzocht. Verder is op systematische wijze geïnventariseerd waarom bepaalde signalen niet tot een contactmoment leidden. Tot slot is op basis van de data bekeken hoe de huidige medicatiebewaking kan worden verbeterd.
Resultaten
Klassieke medicatiebewaking
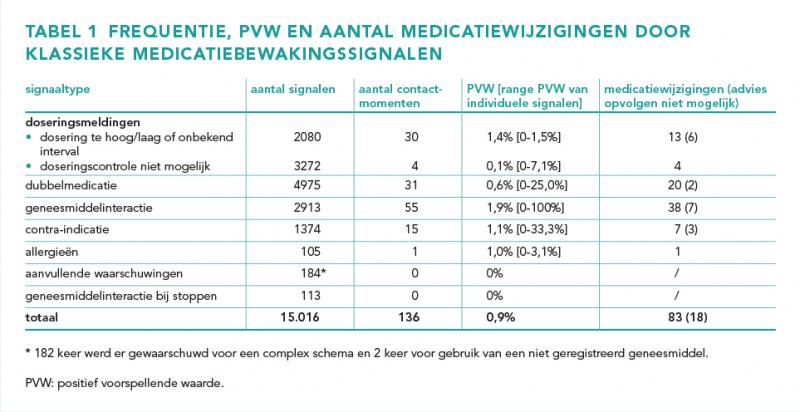
Gedurende de studieperiode voldeden 15.016 klassieke medicatiebewakingssignalen aan de inclusiecriteria. Tabel 1 illustreert het aantal signalen, contactmomenten en medicatiewijzigingen per signaaltype. Deze signalen zijn gebaseerd op 12.171 verschillende medicatieopdrachten afkomstig van 2116 patiënten. Dit komt neer op gemiddeld 7,1 signalen per patiënt en gemiddeld 484 signalen per dag. Het aantal signalen per patiënt varieerde van 1 tot 118.
Van de klassieke medicatiebewakingssignalen leidden 136 signalen tot een contactmoment door een apotheker, wat zorgt voor een algemene PVW van 0,9%. Hiervan leidden 132 contactmomenten tot een advies van de apotheker. Dit heeft geleid tot 83 medicatiewijzigingen. Daarnaast is er zes keer geadviseerd om te monitoren op effectiviteit of bijwerkingen. Er waren 29 adviezen die niet konden worden opgevolgd doordat de patiënt bijvoorbeeld al ontslagen was of het betreffende geneesmiddel reeds gestaakt.
Doseringsmeldingen
Bij dit signaaltype zijn twee categorieën te onderscheiden. Bij de eerste categorie meldingen is sprake van een onbekend doseerinterval of is de dosering hoger/lager dan de gedefinieerde limieten. De tweede categorie bestaat uit meldingen waarbij doseringscontrole niet mogelijk is. Deze categorieën zijn verantwoordelijk voor respectievelijk 2080 (PVW 1,4%) en 3272 signalen (PVW 0,1%). De redenen waardoor deze signalen worden gegenereerd is verschillend. Bij een te lage of te hoge dosering is sprake van een farmaceutisch inhoudelijke reden terwijl de melding ‘doseringscontrole niet mogelijk’ als oorzaak een technische reden heeft.
Dubbelmedicatie
In de onderzoeksperiode zijn 4975 dubbelmedicatiemeldingen gegenereerd waarvan 31 signalen hebben geleid tot een contactmoment (PVW 0,6%). Appendix C (beschikbaar als PDF onderaan dit artikel, sectie Downloads) illustreert geneesmiddelgroepen met meer dan honderd meldingen of ten minste één contactmoment. Voor afhandeling van 2691 van de 4975 signalen bestaan afhandelprotocollen voor de apothekersassistenten. Zij vangen dus al een hoop van de signalen weg. Daarnaast worden veel dubbelmedicatiemeldingen gegenereerd doordat het voorschrijfsysteem geen onderscheid maakt tussen thuismedicatie en opname-/ontslagmedicatie. Zo kan het voorkomen dat hetzelfde geneesmiddel zowel als thuismedicatie als opnamemedicatie is ingevoerd, waardoor een (onterecht) dubbelmedicatiemelding wordt gegenereerd. Ook is vaak sprake van bewuste dubbelmedicatie die door het systeem niet wordt herkend. Dit is bijvoorbeeld het geval wanneer een eenmalige (oplaad)dosis of ‘zo nodig medicatie’ voorafgaand aan een onderhoudsdosis wordt voorgeschreven, of een afbouwschema voor bijvoorbeeld corticosteroïden.
Geneesmiddelinteracties
In totaal zijn 2913 interactiesignalen gegenereerd op basis van 115 verschillende geneesmiddelinteracties. 32 verschillende interacties hebben geleid tot tenminste één contactmoment. Er waren 55 contactmomenten op basis van interacties, wat resulteert in een PVW van 1,9%. De meest voorkomende interacties zijn interacties tussen een Non Steroidal Anti-Inflammatory Drug (NSAID) met een renine-angiotensine-aldosteronsysteem (RAAS)-remmer (537) of diuretica (389). Ook interacties met betrekking tot QT-verlenging zijn veelvoorkomend (505). De PVW van deze interacties varieert van 0,8-3,8%. Vijftien interacties hadden een PVW van 25,0% of hoger en twee interacties een PVW van 100%. Deze vijftien interacties veroorzaakten 39 van de 2913 interactiesignalen. Voor 1709 van de 2913 interactiesignalen bestaan afhandelprotocollen voor assistenten. Het is onbekend hoeveel van de 1709 signalen de assistenten volledig hebben afgehandeld. Een voorbeeld van interacties die assistenten goed kunnen afhandelen zijn tijdsinteracties, welke samen goed zijn voor 520 signalen. Deze interacties hebben tot geen enkel contactmoment door een apotheker geleid. Er zijn twee veelvoorkomende redenen waardoor een contactmoment niet nodig blijkt, namelijk: een patiënt gebruikt twee interacterende middelen al in de thuissituatie en is daarom hier reeds op ingesteld of een van de interacterende middelen is (tot nader order) gestopt. De apotheker of apothekersassistent heeft deze redenen respectievelijk 265 en 189 keer genoteerd als afhandelingstekst bij een interactiesignaal.
Contra-indicaties
Van de 1374 contra-indicatiesignalen kwam de contra-indicatie nierfunctie veruit het vaakst voor, namelijk 965 keer. Deze heeft een PVW van 0,4%. Dit is de laagste PVW van alle contra-indicaties met minimaal één contactmoment. Dit is verklaarbaar door een technische reden. Er wordt namelijk via de clinical rule nierfunctie ook al bewaakt op de nierfunctie. Andere veelvoorkomende contra-indicaties zijn zwangerschap (82), hemodialyse (60), leeftijd < 60 maanden (56), levercirrose (37) en diabetes mellitus (35). Van deze contra-indicaties hebben zwangerschap en diabetes mellitus tot geen enkel contactmoment geleid. De overige veelvoorkomende contra-indicaties hadden een PVW die varieert van 1,7-8,1%. De contra-indicaties refluxziekte en hartfalen hadden een hoge PVW van respectievelijk 25,0% en 33,3%.
Allergieën
Ongeveer de helft van de allergiemeldingen bestaat uit een allergie voor een NSAID (33) of voor lactose (24). De overige allergiemeldingen komen maar één tot enkele keren voor. Eén allergiemelding voor een NSAID heeft geleid tot een contactmoment en medicatiewijziging. Hierdoor heeft de allergiemelding voor een NSAID een PVW van 3,1%. De twee meest genoteerde afhandelingen bij allergiemeldingen zijn ‘akkoord arts’, al dan niet na overleg, en ‘thuismedicatie’.
Clinical rules
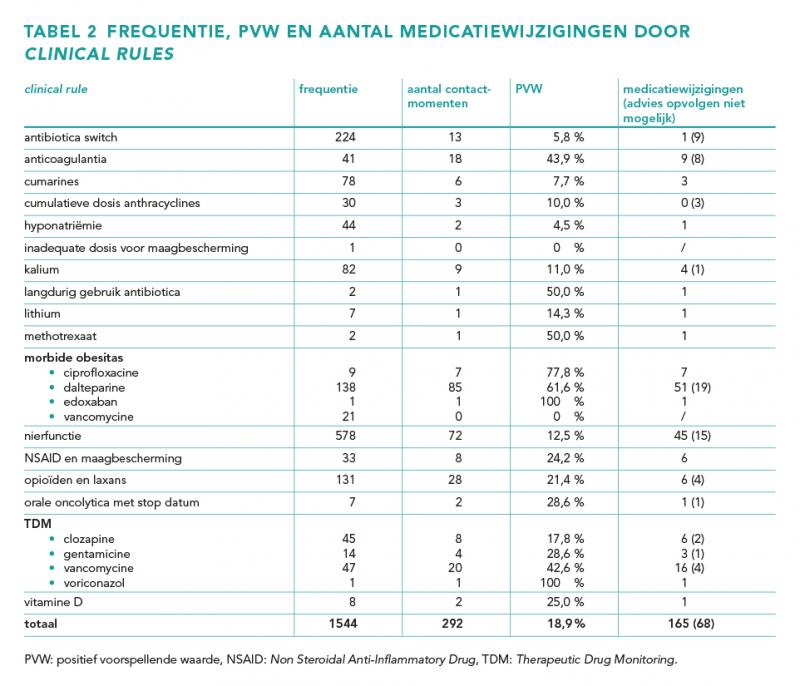
Gedurende de studieperiode zijn 1544 clinical rules gegenereerd voor 681 patiënten. Dit komt neer op gemiddeld 2,3 clinical rules per patiënt. Het aantal clinical rules per patiënt varieert van 1 tot 24.
Van alle rules leidden er 292 tot een contactmoment. Dit resulteert in een PVW van 18,9%. Tijdens 260 van de 292 contactmomenten is er een advies gegeven door de apotheker. Dit heeft in 165 gevallen geleid tot een medicatiewijziging. Het advies kon in 40 gevallen niet worden opgevolgd. In 17 gevallen is door de apotheker alleen het beleid nagevraagd en 11 keer werd na aanvullende informatie van de arts geen advies gegeven.
Tabel 2 illustreert het aantal gegenereerde clinical rules, contactmomenten en medicatiewijzigingen. De frequentie en PVW van de clinical rules varieert sterk, namelijk van 1-578 en 0-100% respectievelijk. Zo resulteren de clinical rules ‘morbide obesitas vancomycine’ en ‘inadequate dosis voor maagbescherming’ in geen enkel contactmoment terwijl de clinical rules ‘therapeutic drug monitoring (TDM) voriconazol’ en ‘morbide obesitas edoxaban’ een PVW hebben van 100%. Deze twee laatstgenoemde rules kwamen echter maar één keer voor.
De clinical rules met de hoogste PVW zijn ‘morbide obesitas ciprofloxacine’, ‘morbide obesitas dalteparine’, ‘anticoagulantia’ en ‘TDM vancomycine’. De PVW’s van deze clinical rules zijn respectievelijk 77,8%, 61,6%, 43,9% en 42,6%.
Een aantal clinical rules heeft door technische redenen een lage PVW. Zo geven de clinical rules ‘hyponatriëmie’ en ‘kalium’ vaak meerdere signalen bij dezelfde patiënt doordat een patiënt gelijktijdig meerdere geneesmiddelen gebruikt die invloed hebben op het natrium en/of kalium. Dit kwam 54 keer voor. Daarnaast kwam 174 keer voor dat de clinical rule ‘nierfunctie’ een signaal genereerde bij een lage profylactische dosis dalteparine waarbij de dosering niet hoeft te worden aangepast.
De clinical rule ‘nierfunctie’ geeft het vaakst een signaal op basis van het gebruik van dalteparine (216), perindopril (39), metoclopramide (37) en acetylsalicylzuur (36). De overige geneesmiddelen van deze clinical rule hebben een frequentie van zeventien of lager. Zeven geneesmiddelen hebben een PVW die hoger is dan 30%, namelijk: meropenem, gentamicine, rivaroxaban, rosuvastatine, valproïnezuur, ciprofloxacine en metformine. Metformine heeft van deze geneesmiddelen met 57,1% de hoogste PVW.
Beschouwing
Uit de resultaten blijkt dat de klassieke medicatiebewaking een stuk minder efficiënt is dan bewaking met clinical rules met PVW’s van respectievelijk 0,9% en 18,9%. Dit is te verklaren doordat clinical rules in staat zijn patiëntkenmerken te betrekken. Deze waarden zijn lager dan de waarden die gevonden zijn in de literatuur. Deze zijn volgens de literatuur 1,4-7,5% voor klassieke medicatiebewaking [2,5-7]. Er zijn meerdere verklaringen denkbaar voor de lagere PVW die uit dit onderzoek naar voren komt. Drie van de vier studies hebben enkel geneesmiddelinteractiesignalen onderzocht. Ook is in de studies gebruikt gemaakt van andere databases dan de G-Standaard. Daarnaast is het mogelijk dat niet alle contactmomenten zijn gedocumenteerd en daardoor gemist worden door het retrospectieve aspect van het onderzoek. Ook de gevonden PVW van clinical rules is een stuk lager dan in de literatuur, 80-94% [8,9].
Dat weinig signalen leiden tot een contactmoment door de apotheker heeft een aantal redenen. Ten eerste de rol van de apothekersassistent. Deze handelen namelijk veel klassieke medicatiebewakingssignalen af en zorgen waar nodig voor een medicatiewijziging. Echter, al deze signalen ziet de apotheker ook nog tijdens het paraferen conform de KNMP-richtlijn Ter hand stellen [4]. Het aantal contactmomenten door apothekersassistenten zijn in deze studie niet onderzocht. Het is ook is niet bekend hoeveel signalen de apothekersassistenten afhandelen. Wel is het zo dat voor meer dan 50% van de gegenereerde interactiesignalen en dubbelmedicatiesignalen afhandelprotocollen bestaan. Gezien de inhoud van de protocollen handelen de apothekersassistenten waarschijnlijk het overgrote deel hiervan zelfstandig af. Ten tweede worden door technische beperkingen veel signalen gegenereerd die zelden tot nooit relevant zijn, zowel bij klassieke medicatiebewaking als bij clinical rules. Dit is bijvoorbeeld het geval bij dubbelmedicatiemeldingen tussen opname- en thuismedicatie, de melding ‘doseringscontrole niet mogelijk’ of dubbel gegenereerde rules, zoals bij de clinical rules ‘hyponatriëmie’ of ‘kalium’. De exacte omvang van deze signalen is onbekend, maar waarschijnlijk aanzienlijk. Zo zijn er bijvoorbeeld acht geneesmiddelengroepen met meer dan honderd dubbelmedicatiemeldingen, maar geen enkel contactmoment door een apotheker. Ten derde worden er signalen gegenereerd die farmaceutisch inhoudelijk niet zinvol zijn, zoals bij bewuste dubbelmedicatie of een verminderde nierfunctie bij een profylactische dosering dalteparine. Ten vierde is er sprake van een grote vervuiling bij allergiemeldingen. Bijvoorbeeld doordat bijwerkingen ten onrechte zijn geregistreerd als allergie of een allergie is geregistreerd bij een geneesmiddel dat in de thuissituatie wordt gebruikt. Ten vijfde speelt de klinische setting een rol in de relevantie van de signalen. De thuismedicatie van een patiënt wordt vaak gecontinueerd in de klinische setting. Signalen op basis van deze thuismedicatie worden over het algemeen geaccepteerd, omdat de patiënt op deze medicatie is ingesteld. Daarnaast zijn een aantal signalen niet relevant in de klinische setting. Een aantal hiervan zijn al uitgeschakeld (zie appendix B, beschikbaar als PDF onderaan dit artikel, sectie Downloads). Een ander voorbeeld zijn meldingen die worden gegenereerd door medicatie die kortdurend rondom een operatie wordt gegeven.
Voorschrijvers krijgen ook medicatiebewakingssignalen te zien, zelfs meer dan apothekers. De omvang en impact hiervan zijn echter niet onderzocht. In de praktijk blijken veel signalen te worden genegeerd. Het is ook mogelijk dat een voorschrijver besluit om een medicatieopdracht aan te passen op basis van een signaal, maar de omvang hiervan is onbekend.
Bij contactmomenten op basis van klassieke medicatiebewaking zijn 132 adviezen gegeven, waarbij 83 adviezen hebben geleid tot een medicatiewijziging (62,9%).
Bij clinical rules is dit het geval bij 165 van 260 adviezen (63,5%). Dit percentage is vergelijkbaar met dat van Rommers et al. (62,8%) en lager dan dat van Muylle et al. (86,9%) [6,10]. Dat het percentage in de studie van Muylle et al. een stuk hoger ligt, is verklaarbaar doordat in deze studie een aantal adviezen niet konden worden opgevolgd. Dit was het geval wanneer een patiënt al was ontslagen of wanneer een medicatieopdracht reeds was gestopt. Daarnaast is een aantal keer geadviseerd om de patiënt te monitoren.
De grootste beperking van deze studie is dat door de retrospectieve opzet contactmomenten kunnen zijn gemist, bijvoorbeeld omdat ze niet op de juiste manier zijn vastgelegd. Daartegenover staat dat door de retrospectieve opzet de gevonden PVW’s niet zijn onderzocht in studieverband, maar de dagelijkse praktijk weergeven. Daarnaast is dit een van de weinige onderzoeken die de efficiëntie van medicatiebewakingssignalen heeft bekeken vanuit het perspectief van de apotheker. Het onderzoek is goed te extrapoleren naar andere ziekenhuisapotheken in Nederland. Een verschil met de huidige situatie is dat de medicatiebewaking sinds de uitvoering van dit onderzoek is uitgebreid met medisch farmaceutische beslisregels. Deze genereren signalen op basis van een beslisboom waarbij meerdere patiëntgegevens kunnen worden betrokken. In de praktijk blijkt echter dat er nog steeds veel signalen worden gegenereerd.
De huidige medicatiebewaking zou op een aantal manieren kunnen worden verbeterd. Een mogelijkheid is het onderdrukken van tijdsinteracties voor apothekers, aangezien deze al door apothekersassistenten worden afgehandeld. Deze interacties waren samen goed voor 520 signalen gedurende de studieperiode. Daarnaast zijn elf geneesmiddelinteracties, goed voor samen 265 signalen, geïdentificeerd die geschikt zijn om door apothekersassistenten te worden afgehandeld. Voor deze geneesmiddelinteracties zijn inmiddels afhandelprotocollen opgesteld. Echter, deze signalen zouden in de huidige situatie nog steeds ook gezien worden door apothekers. Daarnaast komen veel dubbelmedicatiemeldingen tot stand doordat het voorschrijfsysteem geen onderscheid maakt tussen thuismedicatie en opname-/ontslagmedicatie, of niet herkent dat medicatieopdrachten elkaar opvolgen. Dit draagt bij aan een groot aantal onterechte dubbelmedicatiesignalen waarop de apotheker geen actie onderneemt. Dit is het geval bij paracetamol (321 meldingen), insuline (236 meldingen) en diverse geneesmiddelen zonder contactmoment die zijn benoemd in de resultaten. De clinical rules kunnen worden verbeterd door dubbele rules en rules die nooit tot een contactmoment leiden, te onderdrukken. Helaas is het op dit moment technisch niet mogelijk om deze signalen te voorkomen of te onderdrukken, maar dit is wel wenselijk.
Naar aanleiding van het onderzoek zou moeten worden afgewogen of het paraferen van álle medicatieopdrachten door de apotheker, en de tijd die daarmee gepaard gaat, opweegt tegen het aantal contactmomenten en medicatiewijzingen. Een alternatieve optie is het geprotocolleerd en zelfstandig volledig afhandelen van signalen in een verlengde-armconstructie door apothekersassistenten, zonder een laatste controle door de apotheker. Dit kan het aantal signalen zonder contactmoment door de apotheker verminderen. De verlengde-armconstructie kan bijdragen aan een efficiëntere inzet van zorgpersoneel, wat belangrijk is gezien de huidige en toekomstige druk op de zorgcapaciteit. In ons ziekenhuis bestaan al afhandelprotocollen voor 1709 van de 2913 interactiemeldingen die gedurende de studieperiode zijn gegenereerd en wordt gewerkt aan de implementatie van afhandelprotocollen voor nog eens 265 meldingen. Wanneer deze meldingen zelfstandig door assistenten worden afgehandeld en niet meer standaard door apothekers worden gecontroleerd, kan het aantal interactiemeldingen dat apothekers zien met bijna 68% worden verminderd. Met behulp van een risico-inventarisatie en evaluatie moet worden nagegaan of deze optie in de praktijk veilig en haalbaar is. Om zelfstandig afhandelen door apothekersassistenten te implementeren, zou scholing en toetsing moeten plaatsvinden met daarnaast jaarlijkse steekproeven ter evaluatie van de uitvoering. Een andere optie is het loslaten van de klassieke manier van medicatiebewakingssignalen afhandelen door de beschikbare tijd in te zetten op het selecteren en beoordelen van risicopatiënten, waarmee in sommige ziekenhuizen al wordt geëxperimenteerd [11].
Conclusie
In januari 2022 zijn 15.016 klassieke medicatiebewakingssignalen en 1544 clinical rules gegenereerd, waarvan respectievelijk 0,9% en 18,9% leidden tot een contactmoment met de arts door de apotheker. Hoewel medicatiebewaking schade of ongemak voorkomt en de effectiviteit van een geneesmiddel verbetert, is de kans op signaalmoeheid groot. Voornamelijk de PVW van de klassieke medicatiebewaking is erg laag. Alhoewel de PVW van de clinical rules met 18,9% al een stuk hoger is, is ook hier ruimte voor verbetering. Het verbeteren van de medicatiebewaking is echter niet altijd mogelijk door technische beperkingen in het voorschrijfsysteem, die de apotheker niet kan verhelpen. Verder onderzoek naar alternatieve manieren om efficiëntere medicatiebewaking uit te voeren is wenselijk.
Downloads
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. KNMP-richtlijn Medicatiebewaking, versie april 2024 [Internet]. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie [geraadpleegd 2023 dec 13].
https://www.knmp.nl/richtlijnen/medicatiebewaking.
2. Murphy JE, Forrey RA, Desiraju U. Community pharmacists' responses to drug-drug interaction alerts. Am J Health Syst Pharm. 2004 Jul 15;61(14):1484-1487.
3. Reese TJ, Kawamoto K, Fiol GD, et al. When an Alert is Not an Alert: A Pilot Study to Characterize Behavior and Cognition Associated with Medication Alerts. AMIA Annu Symp Proc. 2018 Dec 5;2018:1488-1497.
4. KNMP-richtlijn Ter hand stellen, versie december 2018 [Internet]. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie [geraadpleegd 2024 mei 23].
https://www.knmp.nl/richtlijnen/ter-hand-stellen.
5. Cash JJ. Alert fatigue. Am J Health Syst Pharm. 2009 Dec 1;66(23):2098-2101.
6. Muylle KM, Gentens K, Dupont AG, Cornu P. Evaluation of an optimized context-aware clinical decision support system for drug-drug interaction screening. Int J Med Inform. 2021 Apr;148:104393.
7. Indermitte J, Beutler M, Bruppacher R, Meier CR, Hersberger KE. Management of drug-interaction alerts in community pharmacies. J Clinical Pharm Ther. 2007 Apr;32(2):133-142.
8. Helmons P. Medication safety through information technology: a focus on medication prescribing and administration. s.n. 2014.
9. Scheepers-Hoeks AM, Grouls RJ, Neef C, Korsten HH. Strategy for implementation and first results of advanced clinical decision support in hospital pharmacy practice. Stud Health Technol Inform. 2009;148:142-8.
10. Rommers MK, Zwaveling J, Guchelaar HJ, Teepe-Twiss IM. Evaluation of rule effectiveness and positive predictive value of clinical rules in a Dutch clinical decision support system in daily hospital pharmacy practice. Artif Intell Med. 2013 Sep;59(1):15-21.
11. Duisenberg-van Essenberg M, Brassé B, Saini S, Maat B. Van signalen afhandelen naar patiënten behandelen: Continue farmaceutische patiëntenzorg mogelijk door innovatie in het EPD. Pharm Weekbl. 2022;157(4):8-11.
Referentie
Citeer als: Wouters W, Mitrov-Winkelmolen L, Krens L. De efficiëntie van klassieke medicatiebewakingssignalen en clinical rules vanuit het perspectief van een apotheker in een Nederlandse ziekenhuisapotheek. Nederlands Platform voor Farmaceutisch Onderzoek. 2025;10:a1792.
DOI
https://www.knmp.nl/resolveuid/d5492e25f20a475c805b70ae8238a8dfOpen access


Reactie toevoegen