De invloed van colchicine op de bloedstolling bij patiënten met chronische coronaire aandoeningen die vitamine K-antagonisten gebruiken
- Rubriek: Korte bijdrage
- Identificatie: 2024;9:e1784
Kernpunten
- Colchicine (0,5 mg/dag) is effectief en veilig bij patiënten met coronairlijden.
- Colchicine laat in vitro een remmend effect zien op CYP2C9; bij enkele patiënten is er mogelijk een interactie tussen colchicine en vitamine K-antagonisten (VKA’s).
- In deze studie is geen klinisch relevante interactie tussen colchicine en VKA’s op de International Normalised Ratio (INR), VKA-dosering en de tijd in het therapeutisch gebied (TTR) aangetoond.
- Patiënten met chronische coronaire aandoeningen die een VKA gebruiken, kunnen colchicine (0,5 mg/dag) veilig starten, gebruiken of stoppen.
Abstract
The effect of colchicine on coagulation in patients using vitamin K antagonists with chronic coronary disease
Background
Low-dose colchicine (0.5 mg/day) improves cardiovascular outcomes in patients with coronary disease. Around 12% of these patients simultaneously use anticoagulant therapy. In vitro studies and case reports describe a possible drug interaction between colchicine and vitamin K antagonists (VKAs).
Objective
The aim of this study was to investigate if there is a clinically relevant drug interaction between colchicine and VKAs in patients with chronic coronary disease.
Design and methods
This study was a sub-analysis of the randomized Low-Dose Colchicine 2 (LoDoCo2) trial in which colchicine 0.5 mg once daily was compared with placebo in patients with chronic coronary disease. For the current study we included a sample of patients who used a VKA. All patients were subject to a one month open-label run-in phase in which they received colchicine 0.5 mg once daily. The primary outcome was the within-patient difference in International Normalised Ratio (INR) after starting or stopping colchicine as compared to one month before. Secondary outcomes were difference in mean daily dosage of VKAs and Time in Therapeutic Range (TTR).
Results
In total, 73 patients were included (35 in colchicine group and 38 in placebo group). No difference in mean INR was found after the introduction of colchicine (0.07; 95% confidence interval [CI]: −0.13-0.26; P = 0.50) or when stopping (0.11; 95% CI: −0.12-0.33; P = 0.34). The change in mean VKA daily dosage was −0.01 mg (95% CI: −0.033-0.012; P = 0.35) when starting colchicine and −0.01 mg (95% CI: −0.029-0.012; P = 0.41) when stopping colchicine. The change in TTR one year prior to the study compared to one year after randomization to colchicine was 7.56% (95% CI: −0.14-15.3; P = 0.054).
Conclusion
We found no clinically relevant difference in mean INR in patients using VKAs after starting, using or stopping colchicine. These results suggest that low-dose colchicine can be used safely in patients treated with VKAs, without the need for INR monitoring other than the standard of care.
Inleiding
Hart- en vaatziekten (HVZ) zijn wereldwijd één van de belangrijkste doodsoorzaken [1,2]. Ondanks primaire en secundaire preventie is de morbiditeit en mortaliteit van HVZ nog steeds hoog. Daarom is behoefte aan nieuwe therapeutische strategieën [3-5]. Twee grote gerandomiseerde placebogecontroleerde onderzoeken toonden eerder aan dat colchicine, een middel tegen jicht, in lage dosering (0,5 mg/dag) het risico op belangrijke cardiovasculaire gebeurtenissen significant verlaagt. Dit was zowel bij patiënten met een chronisch coronair syndroom (een relatieve risicoreductie van 31%) als bij patiënten met een recent myocardinfarct (een relatieve risicoreductie van 23%) [6,7].
Naar aanleiding van deze twee onderzoeken wordt colchicine bij patiënten met coronairlijden aanbevolen door de Europese en Amerikaanse richtlijnen [8,9]. Tot 12% van de patiënten met coronairlijden wordt gelijktijdig behandeld met vitamine K-antagonisten (VKA’s).
In vitro heeft colchicine een remmend effect laten zien op CYP2C9, het belangrijkste enzym betrokken bij het metabolisme van VKA’s [10-12]. Dit speelt mogelijk ook in vivo. Een case series rapportage beschrijft ontregelde antistolling en bloeding binnen enkele dagen na start van colchicine in een dosering van 1-6 mg bij VKA-gebruikers [13]. Een grote klinische prospectieve studie heeft echter nog niet plaatsgevonden.
Het doel van deze studie is daarom om te onderzoeken of er een klinisch relevante geneesmiddelinteractie bestaat tussen lage dosering colchicine en VKA’s bij patiënten met een chronisch coronair syndroom.
Methoden
Onderzoeksopzet en onderzoekspopulatie
Dit onderzoek was een subanalyse van het gerandomiseerde, dubbelblinde, placebogecontroleerde Low-Dose Colchicine 2 (LoDoCo2)-onderzoek. Dit Nederlands en Australisch onderzoek liep van 2014 tot 2019, waarbij colchicine in een dosis van 0,5 mg per dag in patiënten met een chronisch coronair syndroom werd onderzocht. Het ontwerp en de resultaten van het onderzoek zijn elders gepubliceerd [6,14]. De huidige subanalyse werd uitgevoerd binnen drie Nederlandse ziekenhuizen: Meander Medisch Centrum, Noordwest Ziekenhuisgroep en Isala Meppel. Alle VKA-gebruikers binnen de LoDoCo2-studie met beschikbare International Normalised Ratio (INR)-gegevens van de trombosedienst vóór en tijdens het onderzoek werden geïncludeerd.
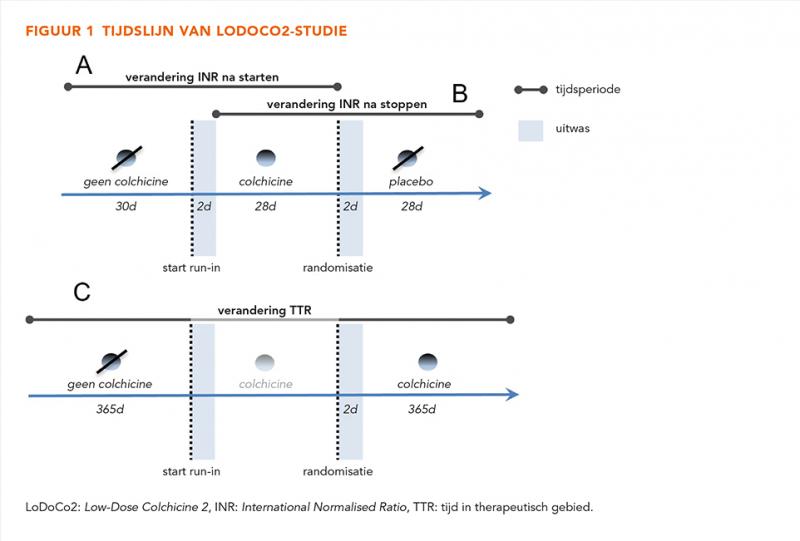
De tijdslijn van de LoDoCo2-studie is weergegeven in figuur 1. Elke deelnemer kreeg gedurende 30 dagen eenmaal per dag 0,5 mg colchicine. Hierna volgde randomisatie naar studiemedicatie (eenmaal per dag 0,5 mg colchicine of placebo).
Uitkomsten
De primaire uitkomstmaat was de intra-individuele verandering in de INR na het starten van colchicine in de open-label run-in fase. Deze verandering was gedefinieerd als het verschil tussen de laatste INR-meting in de 30 dagen voorafgaand aan de behandeling met colchicine en de eerste INR-meting in de 28 dagen na start met de behandeling, rekening houdend met een inwerkperiode van 2 dagen (figuur 1A). De INR-metingen werden in het kader van reguliere zorg uitgevoerd.
De tweede uitkomstmaat was het intra-individuele verschil tussen de VKA-dosering in de 30 dagen voorafgaand aan de behandeling met colchicine en de VKA-dosering in de 28 dagen na de start van de medicatie in de open-label run-in fase (figuur 1A).
De derde uitkomstmaat was de intra-individuele verandering in de INR na stoppen van colchicine in de patiënten-arm die naar placebo werd gerandomiseerd. Hierbij was het verschil tussen de laatste INR-meting van de open-label run-in fase en de eerste INR-meting na randomisatie met placebo binnen 30 dagen berekend, na 2 dagen uitwas (figuur 1B).
De vierde uitkomstmaat was het intra-individuele verschil tussen de VKA-dosering in open-label run-in fase en de VKA-dosering na randomisatie met placebo binnen 30 dagen berekend, na 2 dagen uitwas (figuur 1B).
Voor de vijfde uitkomstmaat is gebruik gemaakt van de naar colchicine gerandomiseerde patiënten-arm. Hiervoor is het intra-individuele verschil in de tijd in het therapeutische gebied (time in therapeutic range, TTR) in de 365 dagen voor de run-in fase en in de 365 dagen na randomisatie met colchicine berekend (figuur 1C). De TTR is bepaald met behulp van de Rosendaal-methode [15]. Een therapeutische INR werd gedefinieerd als INR 2,0-3,0 of INR 2,5-3,5.
Analyse
Continue variabelen werden weergegeven met gemiddelden of medianen met standaarddeviatie van 25ste en 75ste percentiel in het geval van normaal en niet-normaal verdeelde variabelen. De verdelingen werden visueel beoordeeld met behulp van Q-Q-plots. Categorische variabelen werden geanalyseerd als aantallen en percentages.
Intra-individuele veranderingen in INR, VKA-dosering en TTR zijn geanalyseerd met gepaarde t-testen. Het alfaniveau was 0,05. Statistische analyses werden uitgevoerd met SAS 9.4.
Resultaten
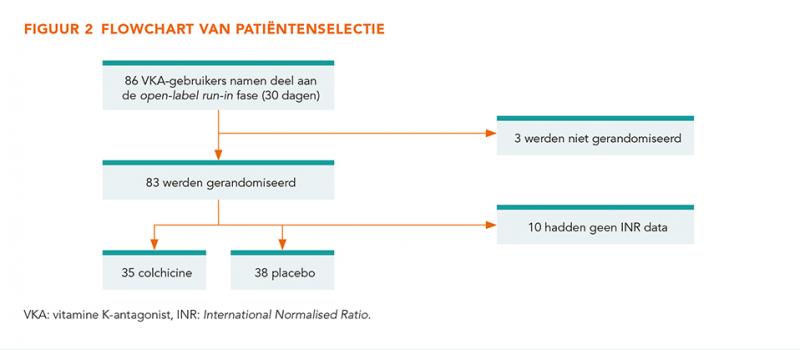
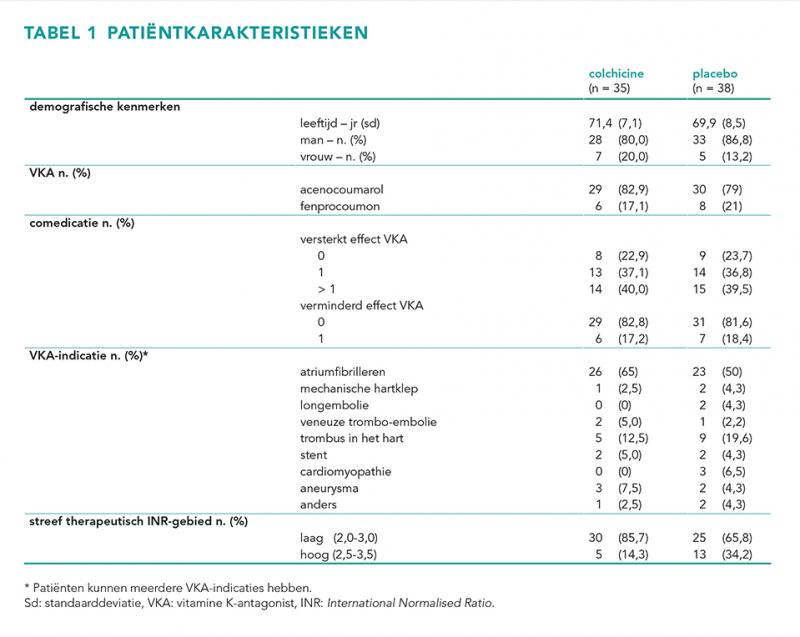
Figuur 2 laat een flowchart zien van de patiëntenselectie. Er waren drie deelnemende centra met in totaal 73 patiënten met een VKA in gebruik en beschikbare INR-data. Hiervan werden 35 in de colchicine- en 38 in de placebogroep gerandomiseerd. De patiëntkarakteristieken zijn weergegeven in tabel 1.
Verandering in INR na starten met colchicine
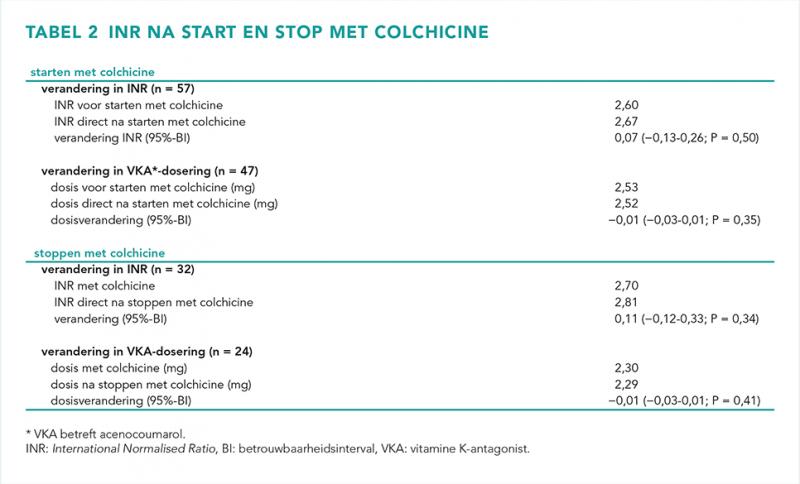
Na starten met colchicine werd geen significante verandering in de INR waargenomen (n = 57). De gemiddelde laatst gemeten INR voorafgaand aan de open-label run-in fase met colchicine was 2,60. De gemiddelde laatst gemeten INR gedurende de open-label run-in fase met colchicine was 2,67. Dit resulteerde in een gemiddeld intra-individuele verschil in INR van 0,07 (95%-betrouwbaarheidsinterval [BI]: −0,13-0,26; P = 0,50), zoals weergegeven in tabel 2. De gemiddelde VKA-dosering was in de periode voor de open-label run-in periode 2,53 mg vergeleken met 2,52 mg in de periode gedurende de open-label run-in fase. Het gemiddelde intra-individuele verschil was −0,01 mg (95%-BI: −0,03-0,01; P = 0,35). Ook gestratificeerd voor type VKA werd geen verschil in gemiddelde INR of dosering van de VKA’s gevonden tussen de periode voor de behandeling met colchicine en de periode met behandeling van colchicine.
Effect op INR na stoppen met colchicine
Stoppen met colchicine (dat wil zeggen loting naar placebo) resulteerde ook niet in een significante verandering in de INR. De gemiddelde INR was 2,70 tijdens de open-label run-in fase waar colchicine werd gebruikt versus een gemiddelde INR van 2,81 na randomisatie naar placebo, met een gemiddeld intra-individuele verschil van 0,11 (95%-BI: −0,12-0,33; P = 0,34). De VKA-dosering veranderde na het stoppen van colchicine ook niet significant. Het intra-individuele verschil in dosering gedurende de behandeling met colchicine en de periode met placebo was −0,01 mg (95%-BI: −0,029-0,012; P = 0,41). De resultaten voor gemiddelde INR en VKA-dosering waren vergelijkbaar bij stratificatie voor type VKA.
Effect op TTR 365 dagen na randomisatie
De TTR in de 365 dagen voor randomisatie was 65,8%, vergeleken met 73,4% na randomisatie, naar colchicine. Een verschil van 7,56% (95%-BI: −0,14-15,3; P = 0,054), zoals weergegeven in tabel 3. Voor de TTR in de placebogroep was dit 66,5% voor randomisatie en 72,5% na randomisatie, een verschil van 5,98% (95%-BI: −0,70- 12,7; P = 0,08). De VKA-dosering veranderde hierbij niet significant.
Beschouwing
In deze subanalyse van het LoDoCo2-onderzoek is geen klinisch relevante interactie tussen laaggedoseerde colchicine en VKA’s waargenomen. Zowel het starten als het stoppen van colchicine resulteerde niet in een significante verandering in de INR, VKA-dosering en TTR.
De relatief lage colchicine-dosering (0,5 mg/dag) speelt mogelijk een rol bij het gebrek aan een klinisch relevante interactie met VKA’s. De dosering was mogelijk niet hoog genoeg om de in vivo activiteit te remmen, ondanks het aangetoonde remmende effect in vitro. In de in vitro studie werd een colchicine-concentratie gebruikt van 1 micromol/L, wat circa 200 keer hoger is dan wat op basis van farmacokinetische studies na orale ingestie van 0,5 mg colchicine kan worden verwacht [16]. Daarnaast werd in de literatuur beschreven case reports, met ontregelde antistolling, een beduidend hogere dagdosis colchicine (1-6 mg/dag) gebruikt [13].
Dit onderzoek had enkele beperkingen, waaronder de mogelijke invloed van de trombosedienst op de INR. Om deze reden is de eerste INR-meting na het beginnen of stoppen van colchicine gebruikt. Indien colchicine invloed uitoefent op de INR, kon de trombosedienst in deze periode nog niet interveniëren. In deze subanalyse kon een beperkt aantal centra worden geïncludeerd. Dit resulteerde in een populatiegrootte van 73 patiënten. Uit de post-hoc poweranalyse kwam een power van 99,9% om een minimaal klinisch relevant INR-verschil van 0,5 te kunnen aantonen [17]. Voor de TTR was dit 81,2%, bij een klinisch relevante daling van 10% [18].
Tot slot, onze data lieten mogelijk het Hawthorne-effect zien. Het Hawthorne-effect is een fenomeen waarbij deelname aan een klinische studie zorgt voor verbetering in (medisch) gedrag [19]. Dit gedrag verandert mogelijk doordat deelnemers weten dat ze aan een (klinische) studie deelnemen en daarmee neemt compliantie over het algemeen toe. In deze studie zou het Hawthorne-effect zich kunnen manifesteren in een verhoogde therapietrouw en daardoor mogelijk minder fluctuatie van de INR. Dit kan resulteren in een verbeterde TTR, ongeacht de behandeling met colchicine of placebo. Het effect is in deze studie waargenomen in beide groepen, wat inderdaad suggereert dat deelname aan de studie zelf, en niet noodzakelijk de interventie (colchicine), heeft geleid tot een verbetering in TTR.
Conclusie
Bij patiënten met chronische coronaire aandoeningen behandeld met een VKA heeft het starten, gebruiken of stoppen van colchicine in een lage dosis van eenmaal daags 0,5 mg geen invloed op de INR, TTR en VKA-dosering. Deze resultaten zijn geruststellend en ondersteunen dat additionele INR-metingen – buiten de reeds gebruikelijke zorg via de trombosedienst – niet nodig zijn bij veranderingen in het gebruik van laaggedoseerde colchicine in combinatie met een VKA.
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. Tsao CW, Aday AW, Almarzooq ZI, et al. Heart Disease and Stroke Statistics-2022 Update: A Report from the American Heart Association. Circulation. 2022 Feb 22:145(8):e153–e639.
2. Roth GA, Mensah GA, Johnson CO, et al. Global Burden of Cardiovascular Diseases and Risk Factors, 1990-2019: Update From the GBD 2019 Study. J Am Coll Cardiol. 2020 Dec 22;76(25):2982–3021.
3. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017 May 4;376(18):1713–1722.
4. Bhatt DL, Steg PG, Miller M, et al. Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. N Engl J Med. 2019 Jan 3;380(1):11–22.
5. Eikelboom JW, Connolly SJ, Bosch J, et al. Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease. N Engl J Med. 2017 Oct 5;377(14):1319–1330.
6. Nidorf SM, Fiolet ATL, Mosterd A, et al. Colchicine in Patients with Chronic Coronary Disease. N Engl J Med. 2020 Nov 5;383(19):1838–1847.
7. Tardif JC, Kouz S, Waters DD, et al. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. N Engl J Med. 2019 Dec 26;381(26):2497–2505.
8. Virani SS, Newby LK, Arnold SV, et al. 2023 AHA/ACC/ACCP/ASPC/NLA/PCNA Guideline for the Management of Patients With Chronic Coronary Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2023 Aug 29148(9):e9–119.
9. Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Vol. 42, Eur Heart J. 2021;42(34):3227–3337.
10. Schalekamp T, Brassé BP, Roijers JF, et al. VKORC1 and CYP2C9 genotypes and phenprocoumon anticoagulation status: Interaction between both genotypes affects dose requirement. Clin Pharmacol Ther. 2007 Feb;81(2):185–93.
11. Schalekamp T, Brassé BP, Roijers JF, et al. VKORC1 and CYP2C9 genotypes and acenocoumarol anticoagulation status: Interaction between both genotypes affects overanticoagulation. Clin Pharmacol Ther. 2006 Jul;80(1):13–22.
12. Dvorák Z, Modriansky M, Pichard-Garcia L, et al.. Colchicine down-regulates cytochrome P450 2B6, 2C8, 2C9, and 3A4 in human hepatocytes by affecting their glucocorticoid receptor-mediated regulation. 2003 Jul;64(1):160-9.
13. Gras-Champel V, Ohlmann P, Polard E, Wiesel ML, Imbs JL, Andréjak M. Can colchicine potentiate the anticoagulant effect of fluindione? Eur J Clin Pharmacol. 2005 Aug;61(7):555–6.
14. Nidorf SM, Fiolet ATL, Eikelboom JW, et al. The effect of low-dose colchicine in patients with stable coronary artery disease: The LoDoCo2 trial rationale, design, and baseline characteristics. Am Heart J. 2019 Dec;218:46–56.
15. Rosendaal FR, Cannegieter SC, van der Meer FJ, Briët E. A method to determine the optimal intensity of oral anticoagulant therapy. Thromb Haemost. 1993 Mar 1;69(3):236-9.
16. Terkeltaub RA, Furst DE, Bennett K, Kook KA, Crockett RS, Davis MW. High versus low dosing of oral colchicine for early acute gout flare: Twenty-four-hour outcome of the first multicenter, randomized, double-blind, placebo-controlled, parallel-group, dose-comparison colchicine study. Arthritis Rheum. 2010 Apr;62(4):1060–8.
17. Meijer P, Kynde K, van den Besselaar AMHP, Van Blerk M, Woods TAL. International normalized ratio (INR) testing in Europe: between-laboratory comparability of test results obtained by Quick and Owren reagents. Clin Chem Lab Med. 2018 Sep 25;56(10):1698–1703.
18. Garrison SR, Green L, Kolber MR, et al. The Effect of Warfarin Administration Time on Anticoagulation Stability (INRange): A Pragmatic Randomized Controlled Trial. Ann Fam Med. 2020 Jan;18(1):42-49.
19. Sedgwick P, Greenwood N. Understanding the Hawthorne effect. BMJ. 2015 Sep 4;351:h4672.
Referentie
Citeer als: Houwen J, Zwaan J, Egberts T, Duyvendak M, Lalmohamed A, Fiolet A, Mosterd A. De invloed van colchicine op de bloedstolling bij patiënten met chronische coronaire aandoeningen die vitamine K-antagonisten gebruiken. Nederlands Platform voor Farmaceutisch Onderzoek. 2024;9:a1784.
DOI
https://www.knmp.nl/resolveuid/20da6d7d876d4d83944f44ff0282626cOpen access


Reactie toevoegen