De invloed van gewicht op de dosis apixaban: een populatiefarmacokinetische analyse op basis van klinische data
- Rubriek: Korte bijdrage
- Identificatie: 2024;9:a1785
Kernpunten
- Er zijn aanwijzingen dat dosisaanpassing van apixaban bij patiënten met overgewicht nodig is.
- Dit is een van de eerste populatiefarmacokinetische (PPK) studies met behulp van klinische data van apixaban bij patiënten met veneuze trombo-embolieën (VTE) of atriumfibrilleren (AF).
- Speciale focus ligt op de correlatie tussen gewicht en verschillende modelparameters om vast te stellen of dosisaanpassing van apixaban op basis van gewicht noodzakelijk is.
- Volgens deze PPK-analyse is voor deze populatie dosisaanpassing bij patiënten tussen de 60 en 125 kg niet nodig.
Abstract
The influence of body weight on apixaban dose: a population pharmacokinetic analysis based on clinical data
Background
Apixaban is administered in a fixed dose regimen and is marketed as a medicine for which routine monitoring, due to its stable pharmacokinetic (PK) profile, is not necessary. Despite the described optimal efficacy and safety, clinical complications (CC) like myocardial infarction, venous thromboembolism (VTE), and bleeding still occur. Moreover, interindividual variability (IIV) in apixaban concentrations at the same dosage was found and was associated with body weight. It was also shown that low trough concentrations and high through concentrations are respectively associated with an increased VTE and bleeding risk. This suggests that in patients with CC , the PK profile may be more variable than expected and dose adjustment may be necessary.
Objective
The objective of this study was to describe the pharmacokinetics of apixaban in a clinical setting by developing a population PK (PPK) model to guide dose optimisation.
Design
Data was collected from three observational studies and included data of hospitalized and outpatient patients (> 18 years) who were prescribed apixaban for the treatment of atrial fibrillation or VTE.
Methods
Apixaban concentration-time points (CTP) were collected, based on which a PPK model was developed. The covariate analysis focused on body size-descriptors, in addition to demographics and clinical characteristics.
Results
426 CTP were collected from 175 patients. A two-compartment model was the most suitable to describe the PPK parameters. The parameters were as follows: renal clearance (CL) 0.65 L/h, non-renal CL 1.48 L/h, central volume of distribution and peripheral volume of distribution, 20 L, intercompartmental CL 0.086 L/h. No covariates were statistically significantly correlated with IIV in model parameters.
Conclusion
Based on this PPK analysis, no dose adjustment of apixaban is needed for patients between 60 and 125 kg.
Inleiding
Direct werkende orale anticoagulantia (DOAC’s), waaronder apixaban, worden als eerste keus antistollingstherapie ingezet bij veneuze trombo-embolieën (VTE) en atriumfibrilleren (AF). Apixaban wordt in een vaste dosering gebruikt en de fabrikant stelt dat routinematige monitoring niet nodig is vanwege het stabiele farmacokinetisch (PK) profiel [1,2].
Ondanks de beschreven optimale werkzaamheid en veiligheid treden tijdens het gebruik van apixaban complicaties op, zoals VTE, myocardinfarcten en bloedingen. Daarbij laat de literatuur zien dat, ondanks de stabiele kinetiek, lage en hoge dalspiegels zijn geassocieerd met respectievelijk een verhoogd VTE en bloedingsrisico [3-7]. Ook is aangetoond dat in de klinische setting een grote interindividuele variabiliteit (IIV) bestaat tussen apixabanconcentraties bij dezelfde dosering [8,9]. Zo werd voor de dalspiegels van apixaban 5 mg een variatiecoëfficiënt van 29 tot 49% gevonden [9]. Dit suggereert dat het PK-profiel van apixaban variabeler is dan verwacht.
De IIV in apixabanconcentraties kan een gevolg zijn van verschillende patiëntfactoren [3-7], met een bewezen negatief verband tussen gewicht en apixaban top- en dalspiegels [7,10-13]. Daarbij is in eerdere populatiefarmacokinetische (PPK) studies met gezonde vrijwilligers een correlatie gevonden tussen het verdelingsvolume en gewicht [14]. De FDA- en KNMP-richtlijnen beschouwen deze associaties als niet klinisch relevant en claimen dat dosisaanpassing niet nodig is bij een gewicht tot 170 kg [15,16]. Of dit ook het geval is bij patiënten is tot op heden onvoldoende onderzocht.
Het doel van deze studie is om de PK van apixaban te beschrijven op basis van real world data. Dit wordt gedaan door middel van de ontwikkeling van een PPK-model, waarbij speciale focus ligt op de correlatie tussen verschillende maten voor gewicht op verschillende modelparameters. Hiermee kan worden vastgesteld of dosisaanpassing op basis van gewicht nodig is.
Methoden
Studieopzet
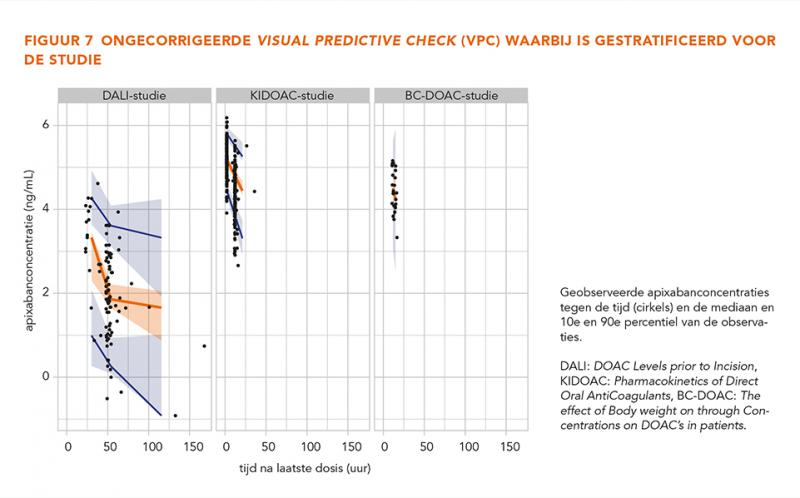
Apixaban concentratie-tijdpunten (CTP’s) werden verzameld uit drie eerdere cohortstudies [9,17,18]. Voor alle studies werd toestemming gegeven door de medisch-ethische toetsingscommissie en bij alle deelnemers werd informed consent afgenomen. De DOAC Levels prior to Incision (DALI)-studie en de Pharmacokinetics of Direct Oral AntiCoagulants (KIDOAC)-studie werden uitgevoerd in het LUMC in Leiden en The effect of Body weight on through Concentrations on DOAC’s in patients (BC-DOAC)-studie is uitgevoerd in het HagaZiekenhuis (HAGA) in Den Haag. In alle drie de studies werden patiënten geïncludeerd die ouder waren dan 18 jaar en minimaal 5 dagen apixaban gebruikten en dus steady state-concentraties hadden bereikt. De DALI-deelnemers ondergingen een geplande operatie (OK) waarvoor hun behandeling met apixaban tijdelijk werd gestaakt.
PK-monsters en bioanalyse
Bij de BC-DOAC-deelnemers werden dalspiegels circa 12 uur na laatste inname afgenomen. In de KIDOAC-studie werden per deelnemer top- en dalspiegels (circa 2 en 12 uur na laatste inname) afgenomen op drie verschillende dagen. Bij de DALI-deelnemers werd na staken van apixaban, conform protocol voor ingrepen, voor de eerste incisie van de OK een spiegel gemeten. In alle studies werd de exacte tijd van bloedafname na inname van de laatste dosis geregistreerd. Monsters werden gemeten met een gevalideerde liquid chromatography-tandem mass spectrometry (LC-MS/MS)-methode in de BC-DOAC- en DALI-studie. In de KIDOAC-studie werden de monsters gemeten aan de hand van een gevalideerde anti-Xa-assay. In alle studies werden demografische factoren, zoals geslacht, leeftijd, gewicht, lengte, indicatie, dosis en interacties verzameld. Ook basis klinische chemie werd verzameld.
Modelontwikkeling
Op basis van literatuuronderzoek en visuele inspectie van de data werden 1- en 2-compartimentmodellen getest [14,19] en om modelstabiliteit te verbeteren werd het perifere verdelingsvolume (Vp) gelijk gesteld aan het centrale verdelingsvolume (Vc). Analoog aan Cirincione et al. werd de klaring (CL) beschreven met een renale en non-renale component, waarbij de geschatte glomerulaire filtratiesnelheid (eGFR, [CKD-EPI]) werd gebruikt voor de renale component [14]. Verder werd gebruik gemaakt van een eerste orde-absorptiemodel waarbij de absorptiesnelheidsconstante (Ka) werd vastgezet op de literatuur [13]. Lognormale distributies werden getest voor de beschrijving van de IIV voor alle modelparameters. Additieve, proportionele en gecombineerde foutmodellen werden beoordeeld voor de residual unexplained variability (RUV). Verder werd getest of splitsing van de RUV per analysemethode een verbetering gaf van de fit.
Model selectie
Modellen werden beoordeeld op basis van afname van de objective function value (OFV = −2 log likelihood). Een afname van de OFV van ≥ 3,84 werd als statistisch significant beschouwd (bij een verschil van 1 punt in vrijheidsgraad komt dit overeen met P < 0,05). Daarbij werden goodness-of-fit (GOF)-grafieken geëvalueerd. Ook de parameter precisie, gekwantificeerd als relatieve standaardfout (RSE) van de geschatte waarde, en plots van IIV-parameters versus covariaten werden beoordeeld.
Covariaten
Na selectie van het structurele en statistische model werden de covariaten leeftijd, geslacht, indicatie, gewicht, lean body weight (LBW) en body mass index (BMI) getest met behulp van stapsgewijze covariaat modelling (scm). Alle covariaten werden getest op de totale CL (CLtot) en het centrale verdelingsvolume (Vc), en geïncludeerd op basis van een voorwaarts inclusiecriterium van P < 0,05 en een achterwaarts eliminatiecriterium van P < 0,01.
Modelevaluatie
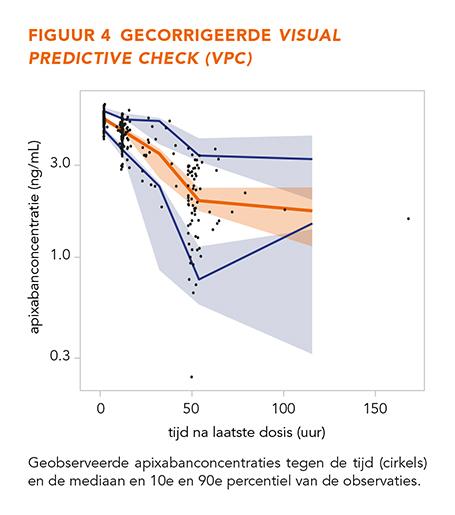
Naast de criteria voor modelselectie werd voor het eindmodel een visual predictive check (VPC) uitgevoerd.
Software
Er is gebruik gemaakt van het non-lineair mixed-effects-modelling programma (NONMEM v.7.4.1), in combinatie met PsN (v.4.7.0), Xpose (v4.7.0) en R (v.3.4.4.). Pirana werd gebruikt voor de integratie van alle software (v.2.9.7.). De first order conditional estimation with interaction-methode werd gebruikt voor analyse.
Resultaten
Demografie
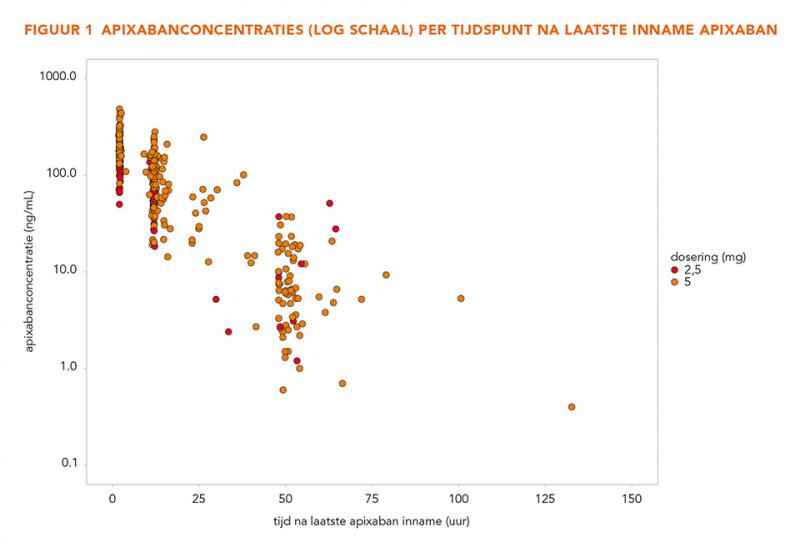
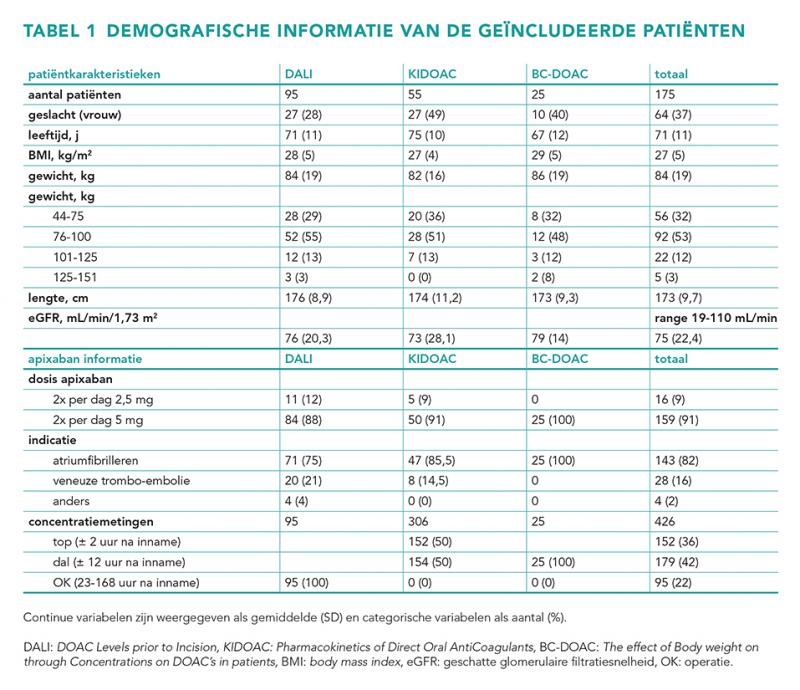
In totaal werden 175 patiënten geïncludeerd waarvan 426 CTP’s beschikbaar waren (figuur 1). Van de patiënten waren 64 vrouw (37%), de gemiddelde leeftijd was 71 jaar (standaarddeviatie [SD] 10,8) en het gemiddeld gewicht was 84 kg (SD 19,1). De karakteristieken van de geïncludeerde patiënten zijn samengevat in tabel 1.
Modelontwikkeling
Een 2-compartimentmodel met eerste orde-absorptie en -eliminatie gaf de beste beschrijving van de PK van apixaban. De IIV is toegevoegd op Ka, CL en Vc. Voor de Ka werd de IIV vastgezet op literatuurwaarden en voor CLtot en Vc werd deze geschat. De RUV werd het best beschreven als proportionele fout en splitsing per analysemethode gaf geen significante verbetering van de fit. De biologische beschikbaarheid (F) was 31% lager bij doseringen > 2,5 mg. Alle parameterwaarden, inclusief IIV, RUV en shrinkage, staan weergegeven in tabel 2. Alle RSE-waarden waren < 50%, wat betekent dat een accurate schatting van parameterwaarden mogelijk was op basis van de beschikbare data.
Covariaten
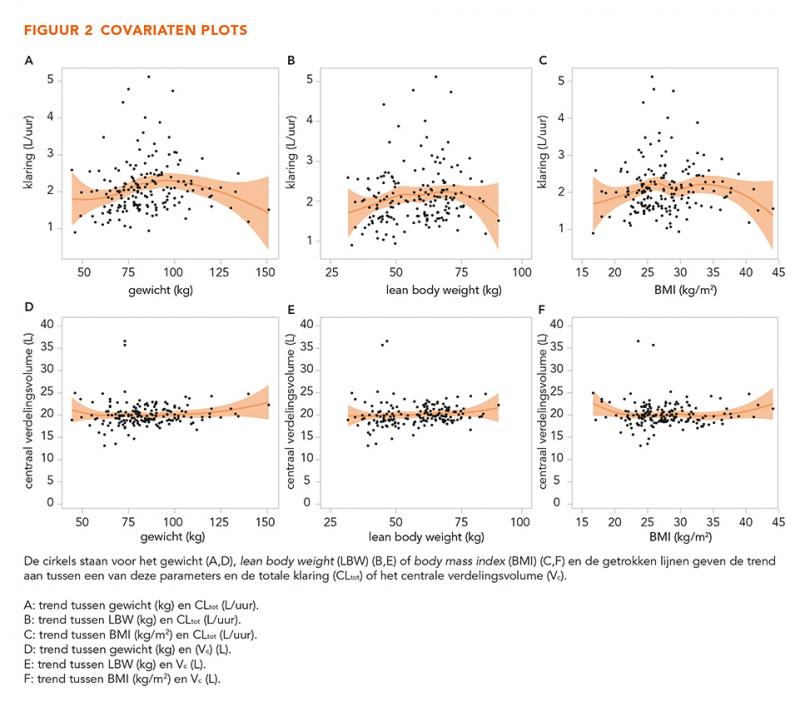
In de scm-procedure werden geen statistisch significante covariaatrelaties gevonden voor Vc en CLtot. In figuur 2 is te zien dat in de bestudeerde populatie geen duidelijke trends zijn tussen CLtot en Vc en gewicht, LBW en BMI.
Modelevaluatie
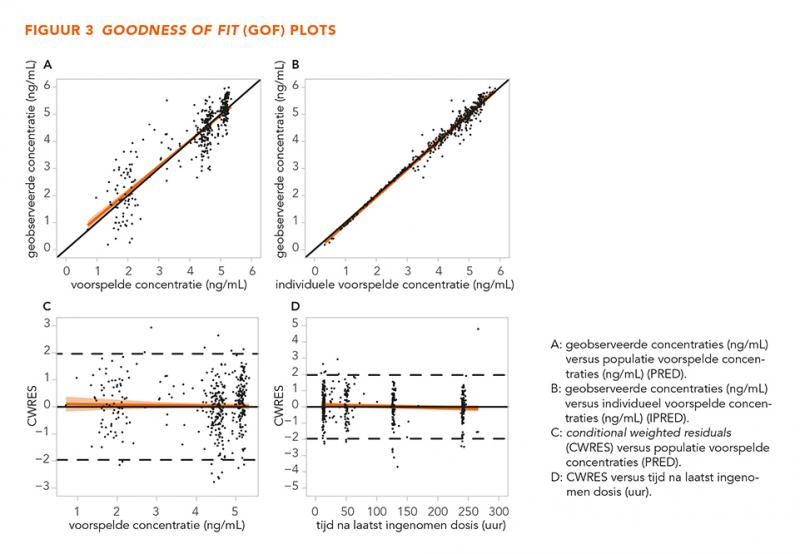
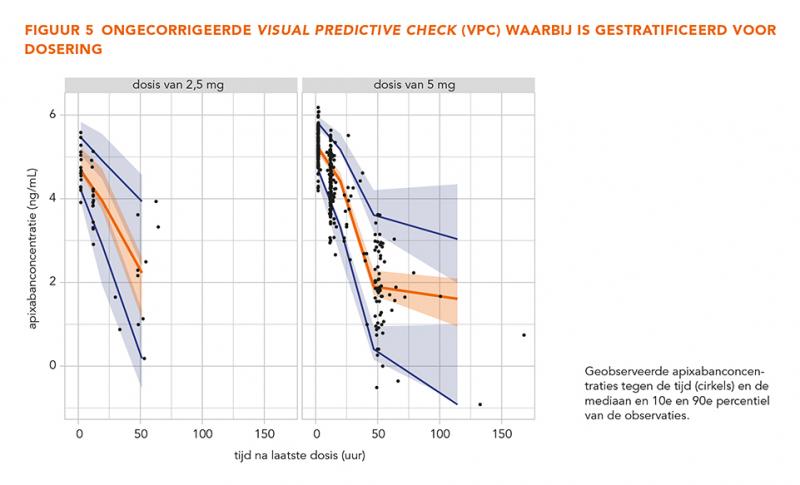
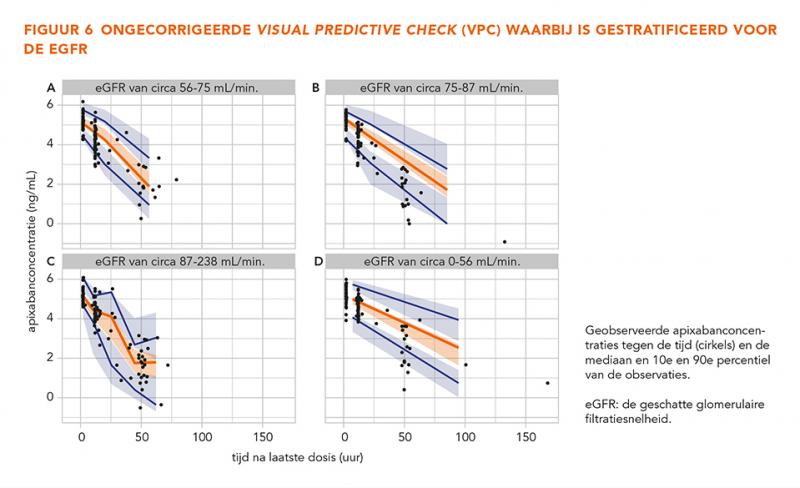
De GOF-grafieken in figuur 3 laten geen trends zien, wat betekent dat het model alle data over het gehele concentratiebereik betrouwbaar beschrijft. De gecorrigeerde en niet-gecorrigeerde gestratificeerde VPC’s (n = 500) in figuur 4-7 tonen dat de geobserveerde mediaan en het 10e en 90e percentiel binnen de voorspelde range liggen. Dit toont aan dat het model de typische trends en de variabiliteit goed voorspelt.
Beschouwing
Dit is één van de eerste PPK-studies van apixaban bij patiënten met VTE of AF. Er werd in deze studie geen statistisch significante correlatie tussen de IIV van het Vc of de CL en gewicht, BMI, of LBW gevonden. Op basis van de resultaten in deze populatie kan worden geconcludeerd dat bij een gewicht tussen 60 en 125 kg en een BMI tussen de 20 en 30 kg/m2 geen dosisaanpassing van apixaban nodig is.
In tegenstelling tot deze studie werd in de literatuur, bij studiepopulaties met vergelijkbare gemiddelde gewichten, een statistisch significante correlatie gevonden tussen gewicht en Vc. Ook werden er voor de renale klaring (CLr), niet-renale klaring (CLnr) en Vc lagere waarden gevonden dan in deze PK-analyse [14,19]. Mogelijke oorzaak hiervan is dat in deze studie gebruik is gemaakt van real world data ten opzichte van fase 1, 2 en 3 data in de studies uit de literatuur [20-25]. Daarnaast had een groot deel van de deelnemers een Aziatische achtergrond in tegenstelling tot Kaukasische achtergrond van deze studiepopulatie.
Bevindingen van PPK-modellen kunnen echter niet zonder meer geëxtrapoleerd worden buiten de range van onderzochte covariaatwaarden. Het is op basis van de huidige beschikbare data niet uit te sluiten dat bij het toevoegen van meer patiënten in de hogere gewichtsrange een effect op lichaamsgewicht wel identificeerbaar is. Gezien het lage aantal spiegels van patiënten onder de 60 kg en boven de 125 kg kunnen er geen conclusies worden getrokken over de dosering bij deze groepen. Vervolgonderzoek met meer spiegels in deze specifieke gewichtsklassen zou hier meer duidelijkheid over kunnen geven.
Deze studie heeft ook een aantal beperkingen. In het finale PPK-model kon de Ka niet worden geschat en werd deze daarom vastgezet op 0,473 uur-1 gebaseerd op de literatuur [14]. De verklaring hiervoor is dat de eerst afgenomen monsters topspiegels waren, wanneer het grootste gedeelte van de absorptie reeds heeft plaatsgevonden.
Ook was het uitdagend om het Vp te kwantificeren, aangezien er een beperkt aantal observaties waren in de distributiefase. Om de stabiliteit van het model te verhogen, is ervoor gekozen om Vp gelijk te stellen aan Vc. Vervolgonderzoek met CTP op tijdstippen in de distributiefase zou een betere schatting van de Vp kunnen geven. Hoewel onze analyse geen externe validatie heeft, geven de RSE, VPC en GOF-plots aan dat de verkregen parameterwaarden op basis van de beschikbare data betrouwbaar geschat konden worden en de beschrijving en voorspelling van de geobserveerde waarden door het model accuraat zijn.
Conclusie
Er werd een PPK-model op basis van data uit de klinische setting ontwikkeld waarbij geen significante invloed van gewicht, LBW of BMI werd gevonden. Hieruit kan geconcludeerd worden dat voor apixaban bij gewichten tussen de 60 en 125 kg geen dosisaanpassing nodig is.
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. Barnes GD, Lucas E, Alexander GC, Goldberger ZD. National Trends in Ambulatory Oral Anticoagulant Use. Am J Med. 2015 Dec;128(12):1300-5.e2.
2. Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest 2016 Feb;149(2):315-352.
3. Gulilat M, Tang A, Gryn SE, et al. Interpatient Variation in Rivaroxaban and Apixaban Plasma Concentrations in Routine Care. Can J Cardiol. 2017 Aug;33(8):1036-1043.
4. Reilly PA, Lehr T, Haertter S, et al. The effect of dabigatran plasma concentrations and patient characteristics on the frequency of ischemic stroke and major bleeding in atrial fibrillation patients: the RE-LY Trial (Randomized Evaluation of Long-Term Anticoagulation Therapy). J Am Coll Cardiol. 2014 Feb 4;63(4):321-8.
5. Ruff CT, Giugliano RP, Braunwald E, et al. Association between edoxaban dose, concentration, anti-Factor Xa activity, and outcomes: an analysis of data from the randomised, double-blind ENGAGE AF-TIMI 48 trial. Lancet. 2015 Jun 6;385(9984):2288-95.
6. Testa S, Paoletti O, Legnani C, et al. Low drug levels and thrombotic complications in high-risk atrial fibrillation patients treated with direct oral anticoagulants. J Thromb Haemost. 2018 May;16(5):842-848.
7. Borst JM, van Rein N, Bakker ECMD, et al. Body weight is negatively associated with direct oral anticoagulant trough concentrations in dabigatran and apixaban users. Br J Haematol. 2020 Dec;191(5):941-944.
8. Gulpen AJW, Ten Cate H, Henskens YMC, et al. The daily practice of direct oral anticoagulant use in patients with atrial fibrillation; an observational cohort study. PLos One. 2019 Jun 6;14(6):e0217302.
9. Testa S, Tripodi A, Legnani C, et al. Plasma levels of direct oral anticoagulants in real life patients with atrial fibrillation: Results observed in four anticoagulation clinics. Thromb Res. 2016 Jan;137:178-183.
10. Toorop MMA, Lijfering WM, Scheres LJJ. The relationship between DOAC levels and clinical outcomes: The measures tell the tale. J Thromb Haemost. 2020 Dec;18(12):3163-3168.
11. Moner-Banet T, Alberio L, Bart PA. Does One Dose Really Fit All? On the Monitoring of Direct Oral Anticoagulants: A Review of the Literature. Hamostaseologie. 2020 Jun;40(2):184-200.
12. Patel JP, Roberts LN, Arya R. Anticoagulating obese patients in the modern era. Br J Haematol. 2011 Oct;155(2):137-49.
13. Upreti VV, Wang J, Barrett YC, et al. Effect of extremes of body weight on the pharmacokinetics, pharmacodynamics, safety and tolerability of apixaban in healthy subjects. Br J Clin Pharmacol. 2013 Dec;76(6):908-16.
14. Cirincione B, Kowalski K, Nielsen J, et al. Population pharmacokinetics of apixaban in subjects with nonvalvular atrial fibrillation. CPT Pharmacometrics Syst Pharmacol. 2018 Nov;7(11):728–738.
15. Clinical pharmacology and biopharmaceutics review(s) [Internet]. Application number: 202155Orig1s000. Center for drug evaluation and research. 2012.
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2012/202155orig1s000clinpharmr.pdf
16. Morbide obesitas: apixaban [Internet]. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie.
https://kennisbank.knmp.nl/files/contra-indicaties_aandoeningen/B0007037.pdf
17. Toorop MMA, van Rein N, Nierman MC, et al. Inter‐ and intra‐indiidual concentrations of direct oral anticoagulants: The KIDOAC study. J Thromb Haemost. 2022 Jan;20(1):92-103.
18. Camilleri E, Shahbabai P, Rad M, et al. Apixaban plasma levels at time of elective surgery: preliminary data from the DALI study. RPTH. ISTH Congress 2022 Abstract number PB0494.
19. Byon W, Sweeney K, Frost C, Boyd RA. Population Pharmacokinetics, Pharmacodynamics, and Exploratory Exposure–Response Analyses of Apixaban in Subjects Treated for Venous Thromboembolism. CPT Pharmacometrics Syst Pharmacol. 2017 May;6(5): 340–349.
20. Frost C, Nepal S, Wang J, et al. Safety, pharmacokinetics and pharmacodynamics of multiple oral doses of apixaban, a factor Xa inhibitor, in healthy subjects. Br J Clin Pharmacol. 2013 Nov;76(5):776–786.
21. Jun M, James MT, Manns BK, et al. The association between kidney function and major bleeding in older adults with atrial fibrillation starting warfarin treatment: population based observational study. BMJ. 2015 Feb 3;350:h246.
22. Chang M, Yu Z, Shenker A, et al. Effect of renal impairment on the pharmacokinetics, pharmacodynamics, and safety of apixaban. J Clin Pharmacol. 2016May;56 (5):637–45.
23. Frost C, Shenker A, Jhee S, Yu Z, Wang J, Bragat A, Pursley J, LaCreta F. Evaluation of the single-dose pharmacokinetics and pharmacodynamics of apixaban in healthy Japanese and Caucasian subjects. Clin Pharmacol. 2018 Oct 24;10:153-163.
24. Yamahira N, Frost C, Fukase H, et al. Safety, tolerability, pharmacokinetics, and pharmacodynamics of multiple doses of apixaban in healthy Japanese male subjects. Int. J. Clin. Pharmacol. Ther. 2014 Jul;52(7):564–573.
25. Frost CE, Song Y, Shenker A, et al. Effects of age and sex on the single‐dose pharmacokinetics and pharmacodynamics of apixaban. Clin. Pharmacokinet. 2015 Jun;54(6):651–662.
Referentie
Citeer als: Weinberg V, Moes DJAR, Chen Q, Camilleri E, Toorop MMA, Borst JM, Visser LE, van Rein N, Krekels EHJ. De invloed van gewicht op de dosis apixaban: een populatiefarmacokinetische analyse op basis van klinische data. Nederlands Platform voor Farmaceutisch Onderzoek. 2024;9:a1785.
DOI
https://www.knmp.nl/resolveuid/2acaa95522a342749b8fcf65f9e04222Open access


Reactie toevoegen