Geneesmiddelgeïnduceerde QT-verlenging: adviezen voor de praktijk
- Rubriek: Overzichtsartikel
- Identificatie: 2025;10:a1790
Kernpunten
- Veel geneesmiddelen verlengen de QT-tijd en geven mogelijk een verhoogd risico op hartritmestoornissen, zoals torsade de pointes (TdP).
- De incidentie van overlijden door TdP wordt ingeschat op 10 per miljoen mensen per jaar.
- In dit artikel geven we handvatten hoe het risico op QT-verlenging is in te schatten en in welke situaties het risico hoog is.
- Bij een hoog risico moet een alternatieve behandeling worden overwogen of moet het QT-interval tijdens behandeling worden gemeten.
Abstract
Drug-induced QT prolongation: advice for practice
Many drugs are associated with QT prolongation on the electrocardiogram and may increase the risk of torsade de pointes (TdP). QT prolonging drugs are prescribed frequently, but the incidence of death due to TdP is estimated to be around 10 per million person years. There is discussion about the management of these risks. For each individual patient risks should be weighed against benefits. We performed a literature review to identify potential risk factors for QT prolongation. High risk factors include hypokalemia, hypocalcemia, heart failure, a history of ventricular arrhythmias, a history of QT prolongation and age above 70 years. Drugs with a high potential for QT prolongation include amiodarone, erythromycin (at doses above 1000 mg per day), quinidine, and sotalol. Drugs that are listed as QT prolonging drugs but probably have a low risk include ciprofloxacin, clarithromycin, domperidone (≤ 30 mg/day), haloperidol (≤ 5 mg/day), and oral ondansetron.
Inleiding
Met een evaluatie van een elektrocardiogram (ECG) kan een inschatting worden gemaakt van het risico op ernstige hartritmestoornissen. Eén van de meest gebruikte maten hiervoor is het QT-interval, waarbij een sterk verlengd QT-interval een hoger risico geeft op hartritmestoornissen. Deze verlenging van het QT-interval kan leiden tot Geneesmiddelgeïnduceerde QT-verlenging: adviezen voor de praktijk de hartritmestoornis torsade de pointes (TdP), die kan overgaan in ventrikelfibrilleren en een acute hartstilstand, wat fataal kan zijn. Veel geneesmiddelen hebben als bijwerking dat zij het QT-interval verlengen [1]. Medicatiebewakingssystemen geven een signaal bij het voorschrijven of afleveren van twee geneesmiddelen die beide een relevante verlenging van de QT-tijd geven. Over de afhandeling van deze signalen bestaat veel discussie vanwege de hoge prevalentie van deze waarschuwingen in combinatie met een relatief lage prevalentie van plotseling overlijden dat toe te schrijven is aan het gebruik van QT-verlengende geneesmiddelen.
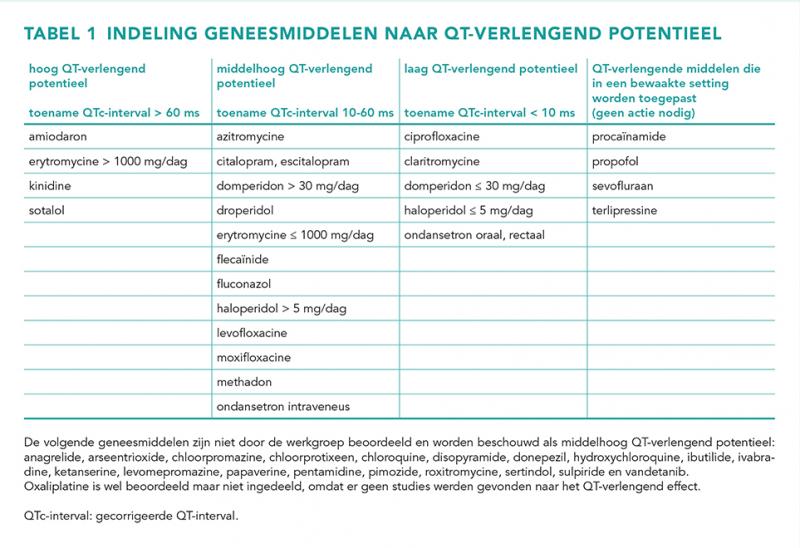
De multidisciplinaire KNMP-werkgroep QT-interacties heeft een literatuuronderzoek uitgevoerd naar klinische studies die de mate van QT-verlenging van bekende QT-verlengende geneesmiddelen evalueren. Op basis hiervan is een inschatting gemaakt van de relevantie van de signalen. Deze informatie is verwerkt in de medicatiebewakingssystemen die zijn gebaseerd op de G-Standaard, waardoor het aantal signalen voor interacties tussen QT-verlengende geneesmiddelen fors is gereduceerd [2]. Bij de wel getoonde signalen is de adviestekst beter afgestemd op de klinische relevantie van de signalen. Daarnaast heeft de werkgroep een literatuuronderzoek gedaan naar studies die op basis van patiëntdata onderzochten wat risicofactoren zijn voor QT-verlenging. Aan de hand hiervan heeft de werkgroep een indeling gemaakt van relevante risicofactoren, die in de overweging kunnen worden meegenomen bij het afhandelen van deze signalen. In dit artikel geven we praktische handvatten hoe om te gaan met interactiesignalen van QT-verlengende middelen, door te bespreken bij welke geneesmiddelen de mate van QT-verlenging laag, gemiddeld of hoog is, en met welke patiëntgerelateerde risicofactoren rekening moet worden gehouden. Uitgangspunt blijft dat voor elke patiënt het individuele risico op TdP ingeschat en afgewogen moet worden tegen de potentiële baten van het geneesmiddel.
Normale hartritme en ernstige hartritmestoornissen
De miljoenen hartspiercellen, cardiomyocyten, worden bij iedere hartslag geactiveerd door kleine elektrische stroompjes. Die stroompjes zorgen samen voor de zogenaamde actiepotentiaal, die weer bestaat uit verschillende fasen van depolarisatie (activatie) en repolarisatie (herstel naar de uitgangssituatie). Deze actiepotentiaal is gebaseerd op het transport van elektrisch geladen natrium-, kalium- en calciumionen door ionkanalen in het celmembraan van de cardiomyocyten. De meeste geneesmiddelen verlengen het QT-interval door remming van IKr-kaliumkanalen, met name de ‘alpha-subunit’ van het kaliumkanaal ‘hERG’ (human ether-a-go-go-related gene), wat wordt gecodeerd door het KCNH2-gen. Hierdoor vertraagt de stroom die deze kanalen produceren en vertraagt de repolarisatie. Het gevolg is dat de actiepotentialen verlengen, er een elektrisch instabiel systeem kan ontstaan en er een hoger risico is op het ontwikkelen van ernstige hartritmestoornissen. Op het ECG is deze actiepotentiaalverlenging terug te zien als een verlenging van het QT-interval. Bij een verlengd QT-interval kunnen de cardiomyocyten door de instabielere vertraagde repolarisatie vroegtijdig gaan depolariseren (after depolarisations), waarschijnlijk door het openen van calciumkanalen, wat vervolgens kan leiden tot TdP [3]. TdP uit zich in symptomen als palpitaties, duizeligheid, tachycardie en syncope. In de meeste gevallen herstelt het hartritme spontaan, maar bij aanhouden kan TdP leiden tot een hartstilstand en plotseling overlijden [4]. Het QT-interval wordt in de regel gecorrigeerd (corrected) voor de hartfrequentie, de zogenaamde QTc. Er zijn meerdere methoden voor deze correctie, waarbij de methode van Bazett de meest gebruikte is (QTc = QT / √RR, waarin het RR-interval de tijd van de voorgaande hartslag is in seconden). Een verlengd QTc-interval wordt vaak gedefinieerd als een QTc-interval boven 450 ms voor mannen en boven 470 ms voor vrouwen. Een QTc-interval langer dan 500 ms, of een verandering van meer dan 60 ms na start van een QT-verlengend geneesmiddel, wordt gezien als een verhoogd risico op TdP.
De incidentie van TdP is moeilijk te schatten, omdat dit óf spontaan herstelt óf leidt tot plotse hartdood. Schattingen van de incidentie van ziekenhuisopnamen door geneesmiddelgeïnduceerde TdP variëren van 4 tot 40 per miljoen mensen per jaar [5-7]. Op basis van een Franse studie uit 1982 die 54 gevallen van TdP bij opgenomen patiënten identificeerde, wordt geschat dat 17% van TdP leidt tot ventrikelfibrilleren, waarvan de helft overlijdt [8]. Met de aanname dat 1% van de gevallen van plotse hartdood wordt veroorzaakt door TdP, is in te schatten dat de incidentie van overlijden door TdP circa 10 per miljoen mensen per jaar is [6]. Benadrukt moet worden dat dit schattingen zijn die met voorzichtigheid moeten worden geïnterpreteerd, maar ze laten zien dat de incidentie van TdP en sterfte door TdP in absolute zin laag is.
Mutaties in genen betrokken bij cardiale ionkanalen, waaronder mutaties in het KCNH2-gen, zijn geassocieerd met een aangeboren verlengd QT-interval; het lange QT-syndroom (LQTS) [9]. Mensen met deze mutaties hebben een verhoogd risico op syncope en vroege hartdood, met name degenen met een QTc-interval boven de 500 ms [10]. Het gebruik van QT-verlengende geneesmiddelen in deze groep mensen brengt extra risico’s met zich mee. Adviezen over het gebruik van QT-verlengende geneesmiddelen bij patiënten met het LQTS vallen buiten de reikwijdte van dit artikel.
Geneesmiddelgeïnduceerde QT-verlenging
Het farmacologische mechanisme achter de QT-verlenging is voor de meeste QT-verlengende geneesmiddelen binding aan het hERG-kaliumkanaal [11]. Echter, niet alle geneesmiddelen die dit kanaal blokkeren zorgen daadwerkelijk voor QT-verlenging. Ook andere mechanismen kunnen hieraan ten grondslag liggen [1,12]. Wanneer QT-verlengende geneesmiddelen worden gecombineerd, kan dat leiden tot meer verlenging van het QT-interval dan de individuele geneesmiddelen afzonderlijk, maar in de regel minder dan de verlenging van de middelen opgeteld [13]. Een lijst van geneesmiddelen die QT-verlengend zijn, wordt bijgehouden door het Arizona Center for Education and Research on Therapeutics (AZCERT) [4]. Deze lijst bevat meer dan 250 geneesmiddelen, die zijn onderverdeeld in ‘conditional risk of TdP’, ‘possible risk of TdP’ en ‘known risk of TdP’. Omdat alleen voor de laatste categorie bewijs bestaat dat de QT-verlenging kan leiden tot TdP, worden alleen combinaties van geneesmiddelen uit deze groep bewaakt. Het QT-verlengend potentieel van de geneesmiddelen uit deze groep is niet even groot. Daarom heeft de werkgroep deze geneesmiddelen verder ingedeeld naar de mate van QT-verlenging. Daarbij is onderscheid gemaakt in een toename van het QTc-interval van meer dan 60 ms (hoog), 10 tot 60 ms (middelhoog), en minder dan 10 ms (laag) (tabel 1) [2]. Doseringen en toedieningsroute zijn indien relevant meegenomen in de beoordeling. De werkgroep heeft hiervoor in de studies gekeken naar de gerapporteerde bovengrens van het 95%-betrouwbaarheidsinterval van het QTc-interval. Geneesmiddelen werden ingedeeld in één van de drie risicocategorieën op basis van de hoogste waarde van de bovengrens die in één van de studies over het betreffende middel werd gerapporteerd. Studies met een klein aantal deelnemers en daarmee een breed betrouwbaarheidsinterval, zijn door de werkgroep geëxcludeerd. Daarnaast zijn geneesmiddelen die alleen in een bewaakte setting worden toegepast, waarbij goed kan worden gemonitord op eventuele ritmestoornissen, in een aparte categorie opgenomen. Deze worden niet bewaakt in de G-Standaard. In tabel 2 geven we voor een aantal geneesmiddelen de onderbouwing voor de gemaakte indeling.
Risicofactoren
Er zijn veel factoren die invloed hebben op het ontstaan van QT-verlenging en TdP. Het concept van de repolarisatiereserve gaat ervan uit dat in een gezond hart voldoende reserve is in de repolarisatietijd om het ontstaan van TdP te onderdrukken [30]. Risicofactoren verminderen deze reserve en verhogen dus het risico op het ontstaan van TdP. Voorbeelden van dergelijke risicofactoren zijn hypokaliëmie, hogere leeftijd, vrouwelijk geslacht en hartfalen [13]. Dat hypokaliëmie een belangrijke risicofactor is, laat een Duitse studie zien waarin 35 ziekenhuisopnamen vanwege geneesmiddelgeïnduceerde TdP werden geïdentificeerd. In deze studie had 60% van de patiënten een hypokaliëmie [31].
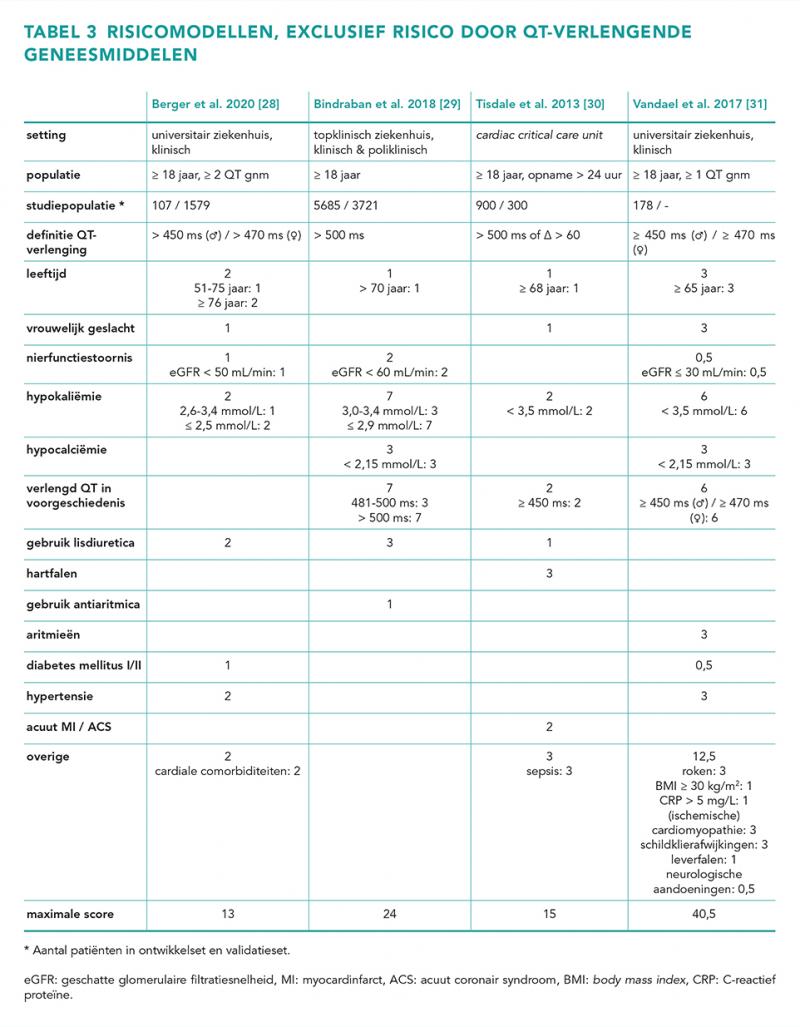
De werkgroep analyseerde studies die risicomodellen hebben ontwikkeld waarmee het risico op QT-verlenging wordt voorspeld, en studies die associaties tussen risicofactoren en het optreden van QT-verlenging of de QTc-tijd onderzochten. In vier studies is op basis van patiëntgegevens een risicomodel ontwikkeld, waarmee het risico op QTc-verlenging kan worden ingeschat (tabel 3) [32-35].
De werkgroep vindt deze modellen onvoldoende representatief en nog onvoldoende gevalideerd om ze te implementeren voor landelijk gebruik. In supplement tabel 1 en 2 (zie Supplement tabel 1 en 2; beschikbaar als PDF onderaan dit artikel, sectie Downloads) staan de andere studies vermeld die de werkgroep heeft beoordeeld en die het effect van risicofactoren op het QTc-interval of QT-verlenging onderzochten. Door de grote diversiteit aan studies, gebruikte methoden en uitkomstmaten zijn de studies niet goed onderling vergelijkbaar. Daarom heeft de werkgroep op basis van consensus een indeling gemaakt van de risicofactoren in hoog, middelhoog en laag QT-verlengend potentieel, aan de hand van de uitkomstmaten in de beoordeelde studies (tabel 4).
Concentratie-effectrelatie
Er is een directe relatie tussen bloedspiegels en binding aan de hERG-kaliumkanalen. Hogere bloedspiegels van QT-verlengende medicatie leiden hierdoor tot meer QT-verlenging [1]. Hogere bloedspiegels kunnen op verschillende manieren ontstaan, bijvoorbeeld door een te hoge infusiesnelheid, geneesmiddelinteracties die leiden tot verminderd metabolisme via bijvoorbeeld remming van cytochroom P450-enzymen, lever- en nierfunctiestoornissen en overdoseringen.
Bradycardie en QRS-verbreding
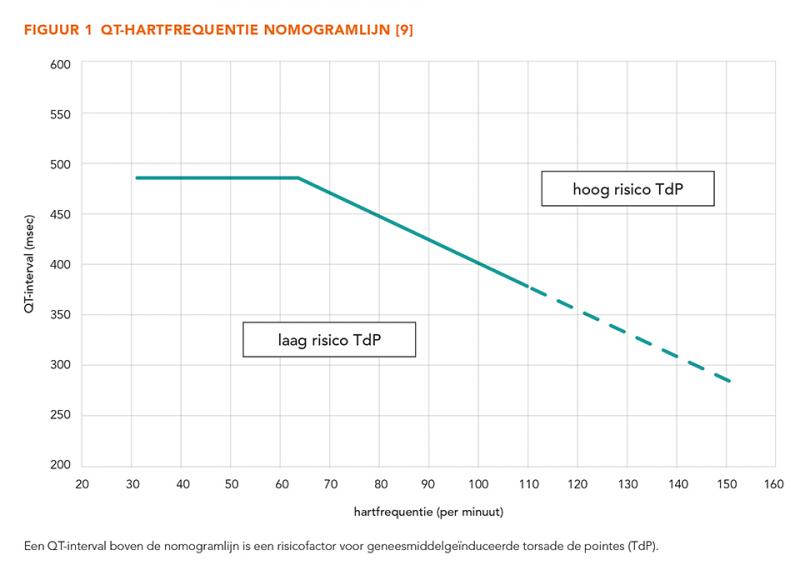
De Bazett-formule geeft een onderschatting van het QTc-interval bij bradycardie [1]. Daardoor zal bij patiënten met een bradycardie die QT-verlengende geneesmiddelen gebruiken het risico op TdP worden onderschat, wanneer het QTc-interval is berekend met de Bazett-formule. Dat is risicovol, omdat een bradycardie op zichzelf ook een risicofactor is voor het optreden van TdP. In het geval van een tachycardie zal het risico op TdP juist worden overschat. Op basis van een groot aantal case reports van geneesmiddelgeïnduceerde TdP is een nomogram opgesteld, waarmee met het QT-interval en hartritme een betere inschatting kan worden gemaakt van het risico op TdP bij geneesmiddelgeïnduceerde QT-verlenging dan met de Bazett-formule (figuur 1) [36].
Een andere situatie doet zich voor als het QRS-interval is verbreed, bijvoorbeeld in het geval van een bundeltakblok of overdoseringen met tricyclische antidepressiva. Omdat het QRS-interval deel uitmaakt van het QT-interval, kan bij QRS-verbreding ook het QT-interval verlengd zijn zonder dat daadwerkelijk sprake is van een verlengde repolarisatietijd. De QTc-tijd moet dan worden gecorrigeerd voor de QRS-verbreding, om een goede inschatting te krijgen van het QTc-interval [37].
Adviezen voor de praktijk
Bij de afhandeling van interacties tussen geneesmiddelen met QT-verlengend potentieel is het van belang de mate van QT-verlenging en de risicofactoren in ogenschouw te nemen. Bij patiënten met meer risicofactoren of met risicofactoren met een hoog risico, zal het gebruik van QT-verlengende medicatie een hoger risico op TdP met zich meebrengen. Bij deze patiënten zal een alternatief geneesmiddel – als dat er is – zonder QT-verlenging de voorkeur hebben. Een andere mogelijkheid is om een ECG af te nemen, bij voorkeur op het moment dat de bloedspiegels van het geneesmiddel hoog zijn, om de mate van QT-verlenging te beoordelen. Bij patiënten met weinig (ernstige) risicofactoren zal het continueren van geneesmiddelen met een QT-verlengend effect – als dat de eerste keus in de behandeling is – de voorkeur hebben. Bij patiënten met een hypokaliëmie of hypocalciëmie, die QT-verlengende medicatie gebruiken zal het corrigeren hiervan hoge prioriteit hebben.
Conclusie
TdP is een relatief zeldzame maar potentieel dodelijke bijwerking van een grote groep geneesmiddelen. Een goede inschatting van de mate van QT-verlenging door (de interacties tussen) QT-verlengende geneesmiddelen in samenhang met aanwezige risicofactoren van de patiënt is belangrijk. Bij een hoog QT-verlengend potentieel kan eerder gezocht worden naar alternatieven of overwogen worden een ECG tijdens de behandeling af te nemen, terwijl bij een laag QT-verlengend potentieel het geneesmiddel mogelijk niet vermeden hoeft te worden.
Downloads
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. Roden DM. Drug-induced prolongation of the QT interval. N Engl J Med. 2004 Mar 4;350(10):1013-22.
2. KNMP werkgroep QT interacties. Drie categorieën en nieuwe adviezen bij QTc-verlenging. Afhandeling van QT-interacties: praktische leidraad bij medicatiebewaking. Pharmaceutisch weekblad. 2018(13): 30-03-2018.
3. Wu J, Wu J, Zipes DP. Early afterdepolarizations, U waves, and torsades de pointes. Circulation. 2002 Feb 12;105(6):675-6.
4. QTdrugs List [internet]. Tucson, AZ USA: AZCERT; [Geraadpleegd 2023 jul 24].
www.CredibleMeds.org.
5. Danielsson B, Collin J, Nyman A, et al. Drug use and torsades de pointes cardiac arrhythmias in Sweden: a nationwide register-based cohort study. BMJ Open. 2020 Mar 12;10(3):e034560.
6. Darpö B. Spectrum of drugs prolonging QT interval and the incidence of torsades de pointes. Eur Heart J Suppl. 2001;3 (supplement K):K70-K80.
7. Vandael E, Vandenberk B, Vandenberghe J, Pincé H, Willems R, Foulon V. Incidence of Torsade de Pointes in a tertiary hospital population. Int J Cardiol. 2017 Sep 15:243:511-15.
8. Milon D, Daubert JC, Saint-Marc C, Gouffault J. Torsade de pointes. Apropos of 54 cases. Ann Fr Anesth Reanim. 1982;1(5):513-20.
9. Moss AJ. Long QT Syndrome. JAMA. 2003 Apr 23-30;289(16):2041-4.
10. Priori SG, Schwartz PJ, Napolitano C, et al. Risk stratification in the long-QT syndrome. N Engl J Med. 2003 May 8;348(19):1866-74.
11. De Bruin ML, Pettersson M, Meyboom RH, Hoes AW, Leufkens HG. Anti-HERG activity and the risk of drug-induced arrhythmias and sudden death. Eur Heart J. 2005 Mar;26(6):590-7.
12. van Noord C, Eijgelsheim M, Stricker BH. Drug- and non-drug-associated QT interval prolongation. Br J Clin Pharmacol. 2010 Jul;70(1):16-23.
13. Heemskerk CPM, Pereboom M, van Stralen K, et al. Risk factors for QTc interval prolongation. Eur J Clin Pharmacol. 2018 Feb;74(2):183-91.
14. Tschida SJ, Guay DR, Straka RJ, et al. QTc-interval prolongation associated with slow intravenous erythromycin lactobionate infusions in critically ill patients: a prospective evaluation and review of the literature. Pharmacotherapy. 1996 Jul-Aug;16(4):663-74.
15. Oberg KC, Bauman JL. QT interval prolongation and torsades de pointes due to erythromycin lactobionate. Pharmacotherapy. 1995 Nov-Dec;15(6):687-92.
16. Hohnloser SH, Klingenheben T, Singh BN. Amiodarone-associated proarrhythmic effects. A review with special reference to torsade de pointes tachycardia. Ann Intern Med. 1994 Oct 1;121(7):529-35.
17. Noel GJ, Natarajan J, Chien S, Hunt TL, Goodman DB, Abels R. Effects of three fluoroquinolones on QT interval in healthy adults after single doses. Clin Pharmacol Ther. 2003 Apr;73(4):292-303.
18. Tsikouris JP, Peeters MJ, Cox CD, Meyerrose GE, Seifert CF. Effects of three fluoroquinolones on QT analysis after standard treatment courses. Ann Noninvasive Electrocardiol. 2006 Jan;11(1):52-6.
19. Heemskerk C, Woldman E, Pereboom M, et al. Ciprofloxacin does not Prolong the QTc Interval: A Clinical Study in ICU Patients and Review of the Literature. J Pharm Pharm Sci. 2017;20(1):360-64.
20. Ray WA, Murray KT, Hall K, Arbogast PG, Stein CM. Azithromycin and the risk of cardiovascular death. N Engl J Med. 2012 May 17;366(20):1881-90.
21. van Haarst AD, van 't Klooster GA, van Gerven JM, et al. The influence of cisapride and clarithromycin on QT intervals in healthy volunteers. Clin Pharmacol Ther. 1998 Nov;64(5):542-6.
22. Démolis JL, Vacheron F, Cardus S, Funck-Brentano C. Effect of single and repeated oral doses of telithromycin on cardiac QT interval in healthy subjects. Clin Pharmacol Ther. 2003 Mar;73(3):242-52.
23. Biewenga J, Keung C, Solanki B, et al. Absence of QTc Prolongation with Domperidone: A Randomized, Double-Blind, Placebo- and Positive-Controlled Thorough QT/QTc Study in Healthy Volunteers. Clin Pharmacol Drug Dev. 2015 Jan;4(1):41-48.
24. Schey R, Saadi M, Midani D, Roberts AC, Parupalli R, Parkman HP. Domperidone to Treat Symptoms of Gastroparesis: Benefits and Side Effects from a Large Single-Center Cohort. Dig Dis Sci. 2016 Dec;61(12):3545-3551.
25. Schrijver EJ, Verstraaten M, van de Ven PM, et al. Low dose oral haloperidol does not prolong QTc interval in older acutely hospitalised adults: a subanalysis of a randomised double-blind placebo-controlled study. J Geriatr Cardiol. 2018 Jun;15(6):401-407.
26. Zuo P, Haberer LJ, Fang L, Hunt TL, Ridgway D, Russo MW. Integration of modeling and simulation to support changes to ondansetron dosing following a randomized, double-blind, placebo-, and active-controlled thorough QT study. J Clin Pharmacol. 2014 Nov;54(11):1221-9.
27. Ganjare A, Kulkarni AP. Comparative electrocardiographic effects of intravenous ondansetron and granisetron in patients undergoing surgery for carcinoma breast: A prospective single-blind randomised trial. Indian J Anaesth. 2013 Jan;57(1):41-5.
28. Yang H, Jeon W, Ko Y, Jeong S, Lee, J. The effect of oral ondansetron on QT interval in children with acute gastroenteritis; a retrospective observational study. BMC Pediatr. 2021 Nov 10;21(1):501.
29. Miller J, House S, Lovato L, et al. Absence of QT prolongation after administration of a 24-mg bimodal-release ondansetron pill (RHB-102). Am J Emerg Med. 2021 May:43:205-209.
30. Roden DM. Taking the "idio" out of "idiosyncratic": predicting torsades de pointes. Pacing Clin Electrophysiol. 1998 May;21(5):1029-34.
31. Sarganas G, Garbe E, Klimpel A, Hering RC, Bronder E, Haverkamp W. Epidemiology of symptomatic drug-induced long QT syndrome and Torsade de Pointes in Germany. Europace. 2014 Jan;16(1):101-8.
32. Berger FA, van der Sijs H, Becker ML, van Gelder T, van den Bemt PMLA. Development and validation of a tool to assess the risk of QT drug-drug interactions in clinical practice. BMC Med Inform Decis Mak. 2020 Jul 23;20(1):171.
33. Bindraban AN, Rolvink J, Berger FA, et al. Development of a risk model for predicting QTc interval prolongation in patients using QTc-prolonging drugs. Int J Clin Pharm. 2018 Oct;40(5):1372-1379.
34. Tisdale JE, Jaynes HA, Kingery JR, et al. Development and validation of a risk score to predict QT interval prolongation in hospitalized patients. Circ Cardiovasc Qual Outcomes. 2013 Jul;6(4):479-87.
35. Vandael E, Vandenberk B, Vandenberghe J, Spriet I, Willems R, Foulon V. Development of a risk score for QTc-prolongation: the RISQ-PATH study. Int J Clin Pharm. 2017 Apr;39(2):424-432.
36. Chan A, Isbister GK, Kirkpatrick CMJ, Dufful SB. Drug-induced QT prolongation and torsades de pointes: evaluation of a QT nomogram. QJM. 2007 Oct;100:609-15.
37. Bogossian H, Frommeyer G, Ninios I, et al. A new experimentally validated formula to calculate the QT interval in the presence of left bundle branch block holds true in the clinical setting. Ann Noninvasive Electrocardiol. 2017 Mar;22(2):e12393.
Referentie
Citeer als: Becker ML, Berger FA, le Comte M, Gieling EM, van Gorp F, Joosten S, Kranenborg M, van Walraven A, Heersche A, Postema PG. Geneesmiddelgeïnduceerde QT-verlenging: adviezen voor de praktijk. Nederlands Platform voor Farmaceutisch Onderzoek. 2025;10:a1790.
DOI
https://www.knmp.nl/resolveuid/00a868da773c4c52b8939513c270deb6Open access



Reactie toevoegen