Een pilotstudie naar de farmaceutische formulering, stabiliteit en afgifteprofiel van een intraperitoneaal toe te dienen hydrogeloplossing met irinotecan
- Rubriek: Korte bijdrage
- Identificatie: 2024;9:e1786
Kernpunten
- Te lage concentraties hydrogeloplossing (4%) leiden tot verlies van de gelvormende eigenschappen.
- Opslag in een kunststof spuit zonder lucht leidt tot een stabieler product dan in een glazen flacon met lucht.
- Middels een hydrogeloplossing 6% kan in vitro een verlengd afgifteprofiel van irinotecan van 24 uur worden verkregen.
- Voordat een hydrogeloplossing klinisch kan worden onderzocht, dienen nog enkele bereidingsaspecten te worden uitgezocht, zoals optimale concentratie en sterilisatietemperatuur.
Abstract
A pilot study on the formulation, stability and release profile of a hydrogel solution with irinotecan intended for intraperitoneal administration
Background
Peritoneal metastases are commonly treated by cytoreductive surgery followed by hyperthermic intraperitoneal chemotherapy. However, survival outcomes remain poor and better treatment options with more effective local drug exposure are warranted. A potential alternative could be an intraperitoneally administered hydrogel solution as carrier for chemotherapy, allowing a slow and controlled drug release from the gel. In this pilot study, we assessed the formulation, stability and in vitro drug release of irinotecan from a biologically resorbable polymer hydrogel solution.
Objective
Define the requirements for a hydrogel solution and explore how this hydrogel solution could be formulated to obtain a stable product that is suitable for use in clinical trials and releases irinotecan over multiple days.
Design and methods
In a qualitative research physicians and pharmacists were interviewed to identify the desired clinical use, formulation and compounding of the polymer hydrogel solution. Outcomes of this study were investigated in an explorative research. The polymer concentration, sterilization temperature, primary package and in vitro release profile were investigated, and stability tests were conducted.
Results
A polymer concentration of 6% resulted in adequate gel forming capacity, whereas this was absent at a concentration of 4%. In vitro, irinotecan was constantly released from a hydrogel solution of 6% during the first 24 hours. High temperatures (116 °C) caused degradation of the polymer, less degradation occurred at 110 °C. Storage in a plastic syringe without air did not negatively affect stability of the hydrogel, however, storage in glass with air resulted in increased viscosity.
Conclusion
This pilot study showed that a stable hydrogel solution of 6% in a plastic syringe can be obtained that is capable of releasing irinotecan over 24 hours. The optimal sterilisation temperature and concentration range has not been established yet. Additional research is needed, before definite conclusions can be drawn.
Inleiding
De prognose voor patiënten met colorectaal carcinoom met geïsoleerde peritoneale metastasen is ongunstig. Sinds enige jaren is voor een selecte patiëntengroep een behandeling bestaande uit cytoreductieve chirurgie gevolgd door hypertherme intraperitoneale chemotherapie (CRS-HIPEC) beschikbaar gekomen. Hierdoor is de mediane overleving ten opzichte van systemische chemotherapie van 17 maanden naar 35 maanden gestegen [1].
HIPEC is een lokale vorm van chemotherapie waarbij een cytostaticumoplossing direct na de operatie in de buikholte wordt gebracht en afhankelijk van het protocol gedurende 30 tot 90 minuten contact maakt met de achtergebleven tumorcellen. In tegenstelling tot systemische chemotherapie kunnen tumorcellen in de slecht doorbloede weefsels hierdoor goed worden bereikt en geeft het minder systemische toxiciteit. Een nadeel van HIPEC is de relatief korte contacttijd van het cytostaticum met het tumorweefsel. Alternatieve behandelopties met langere contacttijd zijn daarom geïndiceerd [2,3].
Op de Technische Universiteit Eindhoven is een hydrogeloplossing (HGO) ontwikkeld gebaseerd op supramoleculaire polymeerchemie. Deze is speciaal ontwikkeld voor intraperitoneale toediening en is gebaseerd op biologisch afbreekbare polymeren [4]. De HGO wordt bereid door het polymeer op te lossen bij 70 °C en pH 9, waarbij een vloeibare HGO ontstaat [5]. Hieraan kan een cytostaticum worden toegevoegd door middel van voor toediening gereed maken (VTGM). In de buikholte heerst een fysiologisch gebufferde pH, waardoor de pH van de HGO na toediening daalt en een hydrogel met hierin cytostaticum vormt [6]. De hypothese is dat door afbraak van de hydrogel het cytostaticum gereguleerd wordt afgegeven waardoor de contacttijd van het cytostaticum met de tumorcellen wordt verlengd. De HGO is tot nog toe alleen preklinisch onderzocht. In dierstudies met knaagdieren is de veiligheid van de HGO aangetoond met een tijdelijk gewichtsverlies en beperkte orgaanschade [7, 8].
Farmaceutische ontwikkeling op het gebied van sterilisatie, concentratierange en primaire verpakking zijn nodig voordat de hydrogel geschikt is voor gebruik in klinische onderzoeken. Om meer inzicht te verkrijgen in de formuleringsmogelijkheden van de hydrogel en het afgifteprofiel hebben we een pilotstudie uitgevoerd welke bestond uit de volgende twee delen:
- Kwalitatief onderzoek naar de formulering, bereiding, toepassing en beoogde toediening van de HGO.
- Exploratief onderzoek naar de stabiliteit en het in vitro afgifteprofiel van cytostatica uit de HGO.
Methoden
Kwalitatief onderzoek
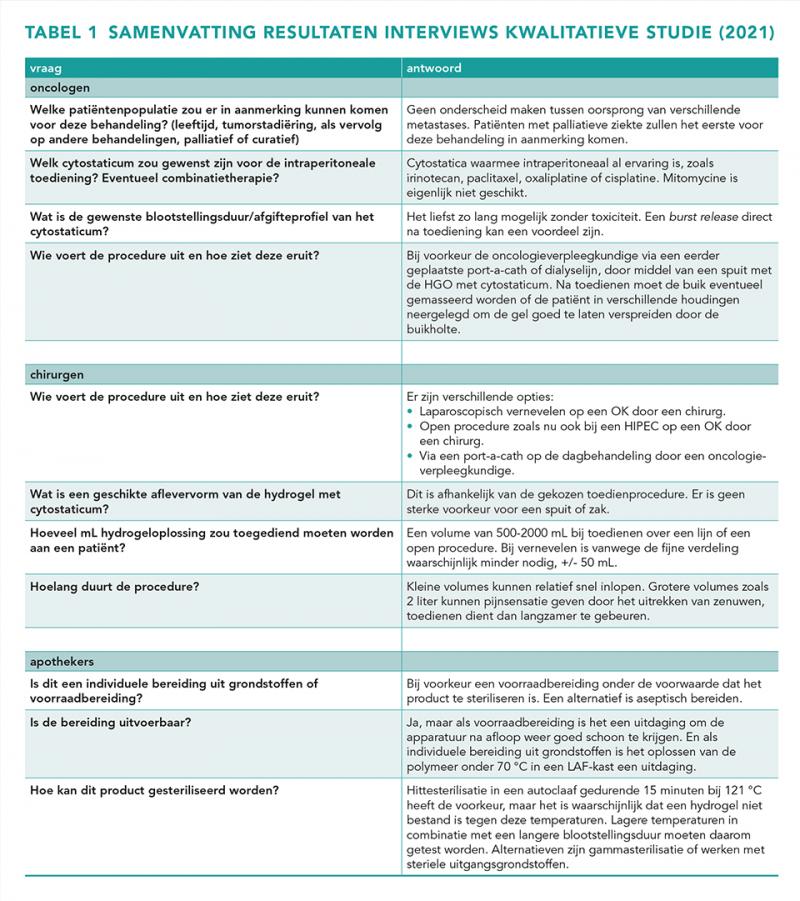
Om de klinisch beoogde toepassing van de HGO in kaart te brengen en te bepalen welke parameters op het gebied van formulering, bereiding, sterilisatie en verpakking onderzocht dienen te worden, is in 2021 een kwalitatieve studie uitgevoerd. Hiervoor zijn twee oncologen, drie chirurgen en drie bereidingsapothekers geïnterviewd. De uitkomsten van de interviews zijn verwerkt in een Design Failure Mode and Effects Analysis (DFMEA). Op basis van de uitkomsten van de DFMEA zijn besluiten genomen ten aanzien van het ontwerp en de parameters gedefinieerd welke in het exploratief onderzoek verder zijn onderzocht.
Exploratief onderzoek
In het exploratief onderzoek zijn de volgende parameters geëvalueerd: concentratie polymeer (voor behoud balans injecteerbaarheid en gelvormende eigenschappen), sterilisatie en primaire verpakking. De Europese Farmacopee stelt dat voor injecteerbare gelen onderzoek moet zijn verricht naar het afgifteprofiel van de actieve stof [9]. Hierbij is irinotecan als actieve stof gekozen, omdat dit in de kwalitatieve studie naar voren kwam als voorkeurscytostaticum.
Stabiliteit HGO
Concentratie polymeer
HGO met twee verschillende polymeerconcentraties (4 en 8%) werd bereid en bewaard in een glazen flacon bij kamertemperatuur. De stabiliteit van de HGO werd middels metingen van pH, viscositeit en molecuulgewicht (gel permeation chromatography [GPC]) beoordeeld op t = 1 maand. Daarnaast werden pH-metingen en visuele beoordeling van de viscositeit uitgevoerd op t = 4 uur, 24 uur, 1 week en 2 weken.
Sterilisatie
Een HGO 6% werd blootgesteld aan sterilisatietemperaturen van 110 °C voor 70 minuten en 116 °C voor 30 minuten [10] in verband met thermo-instabiliteit bij 121 °C. Stabiliteit van de HGO (pH, molecuulgewicht [GPC] en viscositeit) werd beoordeeld voor en na sterilisatie en na aanzuren van de HGO tot fysiologische pH (7,4).
Primaire verpakking
Een HGO 6% werd bewaard in zowel een kunststof (polyolefine) spuit als een glazen flacon. De stabiliteit van de HGO werd middels metingen van pH, viscositeit en molecuulgewicht (GPC) beoordeeld op t = 1 maand. Daarnaast werden pH-metingen en visuele beoordeling van de viscositeit uitgevoerd op t = 4 uur, 24 uur, 1 week en 2 weken.
Afgifteprofiel
Uit een commerciële irinotecan-oplossing en HGO 6% werd een 150 μg/mL irinotecan-HGO-gel bereid (verder: ‘irinogel’). Een laagje van de irinogel werd aangebracht op de bodem van een erlenmeyer en aangezuurd met zoutzuur zodat een gel vormde (in triplo). Hierop werd als oplosmedium een fosfaatgebufferde zoutoplossing (PBS) aangebracht. Op t = 30 min, t = 1, 2, 5, 18, 24, 48 en 72 uur werd een monster uit het oplosmedium genomen. Irinotecan werd gescheiden van de HGO met behulp van filtratiebuizen. De recovery van irinotecan in deze buizen werd hiervoor bepaald.
Irinotecanconcentraties werden geanalyseerd middels Ultra Performance Liquid Chromatography-Diode Array Detection (UPLC-DAD) middels een Acquity UPLC BEH C18-kolom (1,7 μm, 2,1 x 100 mm) van Waters en als mobiele fase een gradiënt van gezuiverd water met mierenzuur 0,2% en acetonitril met mierenzuur 0,2%. De kolom- en sampletemperatuur waren respectievelijk 40 °C en 10 °C, het injectievolume 5 μL en de loopsnelheid 0,4 mL/min. Detectie vond plaats bij 370 nm.
Resultaten
Kwalitatief onderzoek
Er zijn in totaal 26 vragen gesteld aan de artsen en apothekers. De conclusie was dat de HGO bij voorkeur een voorraadbereiding is en gesteriliseerd wordt door hittesterilisatie. De samenvatting van de vragen en antwoorden staan in tabel 1. Aan de hand van de DFMEA werden de te onderzoeken parameters gedefinieerd (zie Methoden).
Exploratief onderzoek
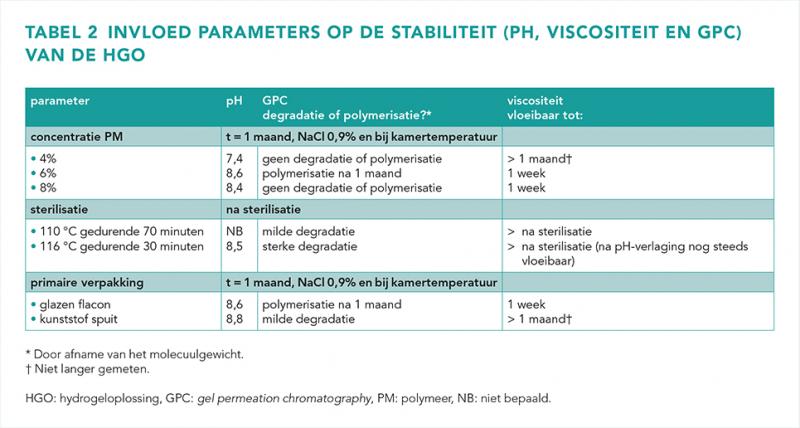
In tabel 2 zijn de stabiliteitsresultaten per onderzochte parameter weergegeven.
Stabiliteit HGO
Concentratie polymeer
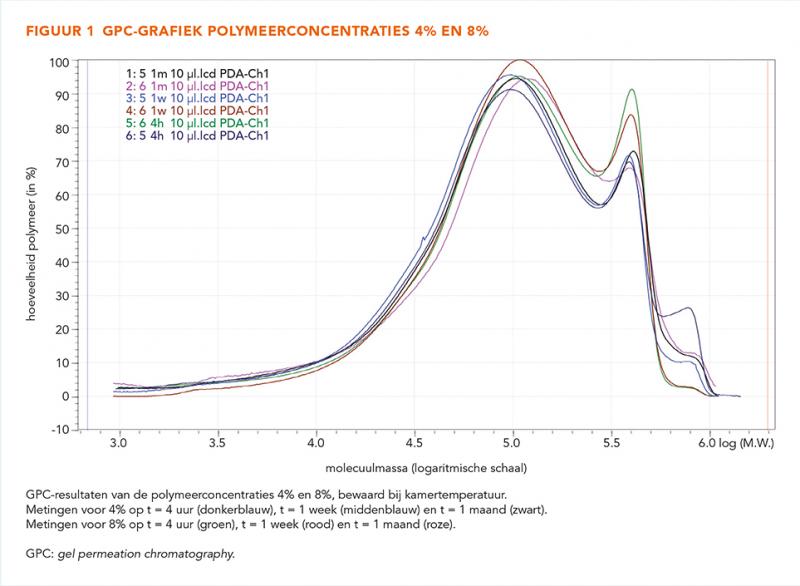
De pH van de HGO 4% daalde na 2 weken tot pH < 7,5, zonder gelvorming. De HGO 8% was na 1 week te viskeus voor verdere bewerking, ondanks dat de pH > 8,0 was. GPC-analyse liet in beide concentraties geen polymerisatie of degradatie van het polymeer zien (figuur 1)
Sterilisatie
Sterilisatie bij 116 °C leidde tot een pH-daling van 8,8 naar 8,5 en degradatie van het polymeer. Tevens verloor de HGO de gelvormende eigenschappen. Sterilisatie bij 110 °C resulteerde in vergelijking met 116 °C in minder degradatie. Het behoud van gelvormende eigenschappen na sterilisatie bij 110 °C is niet getest.
Primaire verpakking
De HGO bleef ten minste 1 maand vloeibaar bij opslag in een kunststof spuit zonder lucht. De pH van de HGO bleef stabiel en de gelvormende eigenschappen behouden. Na 1 maand in een kunststof spuit werd milde degradatie gezien. In glas trad al na 1 week polymerisatie en toename van viscositeit op.
Afgifteprofiel
Na 2,5 uur was gemiddeld 52% van de irinotecan afgegeven en na 24 uur werd de gemiddelde maximaal cumulatieve afgifte bereikt. Binnen 48 uur was op de bodem van de erlenmeyers geen gel meer zichtbaar (figuur 2).
Beschouwing
Deze studie betreft een kwalitatieve en exploratieve studie naar een mogelijk alternatieve toedieningsvorm van intraperitoneale chemotherapie. Aangetoond is dat HGO 6% in combinatie met irinotecan in vitro gedurende 24 uur voor een gereguleerde afgifte van irinotecan zorgt. Ondanks dat dit al een grote toename is ten opzichte van de huidige blootstellingsduur, wordt idealiter een afgifte van 2-3 dagen verkregen. Modificaties van het polymeer zijn hiervoor nodig.
Uit deze studie blijkt dat de HGO niet kan worden verdund naar polymeerconcentraties ≤ 4%, omdat er bij deze concentraties geen gel wordt gevormd bij fysiologische pH. Verdunnen van de HGO is dus beperkt mogelijk. Dit is bijvoorbeeld van belang bij het gebruik van cytostaticaoplossingen met een lage concentratie, zoals cisplatine (1 mg/mL), waarbij grotere volumes toegevoegd zouden moeten worden om vergelijkbare doseringen te verkrijgen als bij HIPEC. Ongeacht de concentratie van het toe te voegen cytostaticum, is het dus van belang dat de concentratie polymeer 6% blijft.
Sterilisatie van de HGO bij temperaturen vanaf 116 °C is niet mogelijk. Deze temperatuur leidt tot te veel degradatie van het polymeer en verlies van de gelvormende eigenschappen. Na sterilisatie bij 110 °C wordt ook degradatie gezien, maar in mindere mate. Of gelvormende eigenschappen behouden zijn gebleven dient nog onderzocht te worden.
Opvallend is dat de viscositeit van de HGO in glazen flacons binnen een week toeneemt, maar in een kunststof spuit niet. Mogelijk komt dit door de aanwezigheid van lucht of zuurstof in de glazen flacon die de HGO “uitdroogt” en in de kunststof spuit niet aanwezig is. Dit suggereert dat de HGO het beste lucht- of zuurstofvrij dient te worden bewaard.
In eerdere afgiftestudies is het afgifteprofiel uit de HGO bepaald in PBS [5, 11]. PBS kan dus gebruikt worden voor dit soort testen, maar is niet volledig representatief voor de fysiologische intraperitoneale omgeving. Vervolgonderzoek met een ander oplosmedium zou de in vivo afgifte mogelijk nog beter kunnen benaderen.
Conclusie
Het aanbieden van cytostatica in de buikholte in de vorm van een gel biedt een alternatieve methode voor intraperitoneale therapie waarbij de blootstelling lokaal verlengd kan worden met een beoogd beter effect van behandeling voor patiënten met peritoneaal metastasen. De resultaten van deze pilotstudie laten zien dat het mogelijk is om met de huidige HGO 6% in vitro gedurende 24 uur een gereguleerde afgifte van irinotecan te behalen. Verder onderzoek naar sterilisatietemperaturen, stabiliteit in de primaire verpakking, concentratierange en polymeermodificaties zijn nodig om uiteindelijk een HGO te ontwikkelen die geschikt is voor gebruik in de kliniek.
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. Franko J, Ibrahim Z, Gusani NJ, Holtzman MP, Bartlett DL, Zeh HJ 3rd. Cytoreductive surgery and hyperthermic intraperitoneal chemoperfusion versus systemic chemotherapy alone for colorectal peritoneal carcinomatosis. Cancer. 2010 Aug 15;116(16)3756-62.
2. Maruyama M, Nagahama T, Yuasa Y. Intraperitoneal versus intravenous CPT-11 for peritoneal seeding and liver metastasis. Anticancer Res. 1999 Sep-Oct;19(5B):4187-91.
3. de Boer NL, Brandt-Kerkhof ARM, Madsen EVE, et al. Concomitant intraperitoneal and systemic chemotherapy for extensive peritoneal metastases of colorectal origin: protocol of the multicentre, open-label, phase I, dose-escalation INTERACT trial. BMJ Open. 2019 Dec 8;9(12):e034508.
4. Bakker MH. Supramolecular drug delivery systems: molecular engineering of carrier affinity. Eindhoven: Technische Universiteit Eindhoven, 2018.
5. Pape AC, Bakker MH, Tseng CC, et al. An Injectable and Drug-loaded Supramolecular Hydrogel for Local Catheter Injection into the Pig Heart. J Vis Exp. 2015 Jun 7;(100):e52450.
6. Bakker MH, Dankers PYW. 9 - Supramolecular biomaterials based on ureidopyrimidinone and benzene-1,3,5-tricarboxamide moieties,” Self-assembling Biomaterials. 2018:177-204.
7. Wintjens AGWE, Liu H, Fransen PPKH, et al. Treating colorectal peritoneal metastases with an injectable cytostatic loaded supramolecular hydrogel in a rodent animal model. Clin Exp Metastasis. 2023 Jun;40(3):243-253.
8. Wintjens AGWE, Fransen PPKH, Lenaerts K, et al. Development of a Supramolecular Hydrogel for Intraperitoneal Injections. Macromol. Biosci. 2024 Jan;24(1):e2300005.
9. Parenteral preparations. In: European Pharmacopoeia 10.0, 0520 (07/2021).
10. Perkins JJ. Principles and Methods of Sterilization in Health Sciences. Second edition. Springfield: Charles C Thomas Publisher, 1969.
11. Ray MD, Dhall K. Hyperthermic Intraperitoneal Chemotherapy (HIPEC) in the management of peritoneal surface malignancies – An evidence-based review. Curr Probl Cancer. 2021 Dec;45(6):100737.
Referentie
Citeer als: Laarhuis SRE, Fransen PPKH, van Almen GC, de Hingh IHJT, van Wezel RAC, Deenen MJ. Een pilotstudie naar de farmaceutische formulering, stabiliteit en afgifteprofiel van een intraperitoneaal toe te dienen hydrogeloplossing met irinotecan. Nederlands Platform voor Farmaceutisch Onderzoek. 2024;9:a1786.
DOI
https://www.knmp.nl/resolveuid/cd089603a99041fb8bc573e321525640Open access


Reactie toevoegen