De invloed van microbioom-beïnvloedende comedicatie op de effectiviteit van immunotherapie in patiënten met stadium IV niet-kleincellige longkanker
- Rubriek: Korte bijdrage
- Identificatie: 2021;6:a1741
Kernpunten
- Bij patiënten met stadium IV niet-kleincellige longkanker is het gebruik van antibiotica en opiaten geassocieerd met slechtere overlevingsuitkomsten.
- Deze negatieve invloed van antibiotica en opiaten op de overleving wordt waargenomen in zowel immunotherapie- als chemotherapiepatiënten.
- Dit is een aanwijzing dat de associatie het gevolg is van prognostische verschillen in plaats van medicatiegerelateerde veranderingen van het microbioom (die alleen van invloed zouden zijn bij immunotherapie).
Abstract
The association between gut microbiome affecting drugs and the effectiveness of immunotherapy in stage IV NSCLC patients
Objectives
This study investigated the influence of microbiome-affecting-medication on the effectiveness of immunotherapy in patients with stage IV non-small cell lung cancer (NSCLC).
Methods
Immunotherapy patients were matched (1:1) to patients treated with chemotherapy in the pre immunotherapy era. The association between the use of antibiotics, opioids, proton pump inhibitors, metformin and other antidiabetics on overall survival (OS) and progression free survival (PFS) was assessed with multivariable cox-regression analyses. Interaction tests were applied to investigate whether the association differs between patients treated with immuno- or chemotherapy.
Results
A total of 442 patients were studied. The use of antibiotics was associated with worse OS (adjusted Hazard Ratio [aHR] = 1.39; P = 0.02) and worse PFS (aHR = 1.44; P < 0.01) independent of the type of therapy (chemotherapy or immunotherapy). The use of opioids was associated with worse OS (aHR = 1.33; P = 0.01) but not with PFS. The other drugs studied showed no association with the two outcomes. There was no effect modification from the type of therapy as confirmed by no statistically significant interaction terms.
Conclusion
The use of antibiotics and opioids in NSCLC patients is similarly associated with worse outcomes in both chemotherapy and immunotherapy. This suggests that the association is likely to be a consequence of confounding by indication rather than affection of the microbiome.
Inleiding
Voor de behandeling van patiënten met een niet-kleincellig longcarcinoom (NSCLC) stadium IIIB/IV was platinumhoudende chemotherapie lange tijd eerste keus therapie, maar sinds de ontwikkeling van nieuwe (doelgerichte) behandeltherapieën is dit niet meer het geval. Vanaf 2015 zijn de checkpointremmers nivolumab, pembrolizumab en atezolizumab in Nederland beschikbaar. Dit wordt ook wel immunotherapie genoemd. Het zijn antilichamen gericht tegen het geprogrammeerde celdood-1 (PD-1)-molecuul of de ligand ervan (PD-L1), waardoor de T-celrespons geactiveerd wordt om kankercellen te doden [1,2].
Er zijn aanwijzingen dat het microbioom in de darm invloed kan hebben op de werkzaamheid van immunotherapie [3]. Routy e.a. toonde aan dat patiënten met een goede response op immunotherapie een grotere diversiteit hebben aan micro-organismen in de darm dan patiënten met een slechte response op immunotherapie [4]. De samenstelling van het microbioom is onder andere afhankelijk van leefstijl, voeding en geneesmiddelgebruik.
Recent hebben meerdere observationele studies een negatieve associatie tussen antibioticagebruik en de effectiviteit van immunotherapie gevonden [4-6]. Een belangrijke methodologische beperking van deze studies is dat er niet maximaal rekening gehouden werd met de mogelijke aanwezigheid van confounding by indication, een situatie waarbij de indicatie – in plaats van het gebruikte geneesmiddel – een voorspeller is voor de effectiviteit van immunotherapie. Dit kwam mede omdat deze studies werden uitgevoerd met uitsluitend patiënten die immunotherapie kregen. Een mogelijkheid om deze bias te beperken zou een studieopzet zijn waarin ook patiënten zitten die met chemotherapie zijn behandeld. Immers, er wordt geen relatie tussen het microbioom en de effectiviteit van chemotherapie verondersteld.
Het doel van de huidige studie is om door middel van een historisch matched cohort design te onderzoeken of de invloed van microbioom-beïnvloedende comedicatie op de effectiviteit van de behandeling in patiënten met stadium IV NSCLC verschilt tussen immunotherapie en chemotherapie.
Methode
Dit is een retrospectieve, observationele, historisch gematchte cohortstudie waarbij er gebruik wordt gemaakt van klinische data vanuit zes van de zeven Santeon ziekenhuizen in Nederland.
Vanuit de Nederlandse Kankerregistratie zijn alle patiënten met de primaire diagnose stadium IV NSCLC geïdentificeerd. Vervolgens is de Santeon Farmadatabase gebruikt om per patiënt de toegepaste systeemtherapie(ën) te identificeren. Patiëntkenmerken en informatie over comedicatie zijn verkregen door raadpleging van de elektronische patiëntendossiers in de ziekenhuizen. Alle verkregen data is verwerkt en opgeslagen in een beveiligde omgeving (Research Electronic Data capture database [REDcap]). Tot de immunotherapiegroep zijn gerekend alle patiënten gediagnosticeerd met stadium IV NSCLC tussen 1 januari 2015 en 1 januari 2019 en op enig moment behandeld met immunotherapie. Vervolgens is iedere immunotherapiepatiënt gematcht (1:1) met een patiënt gediagnosticeerd met stadium IV NSCLC voor 2015 (= pre-immunotherapie tijdperk) en behandeld met chemotherapie [7]. Patiënten zijn gematcht op geslacht, leeftijd en lijn van de systemische behandeling.
Voor iedere patiënt is vastgesteld of er sprake was van gebruik van de volgende microbioom-beïnvloedende geneesmiddelen: antibiotica, protonpompremmers (PPI), opiaten, metformine en overige diabetesmiddelen [8,9]. Blootstelling werd gedefinieerd als chronisch gebruik (ongeacht toedieningsvorm) van een van deze middelen (of kuren in het geval van antibiotica), vanaf 1 maand voorafgaand aan tot aan 1 maand na de start van immunotherapie of chemotherapie.
Als uitkomstparameters zijn gehanteerd de algemene overleving (OS) en de progressie vrije overleving (PFS). De OS wordt gedefinieerd als een periode vanaf de start van de behandeling tot aan overlijden en de PFS wordt gedefinieerd als de periode vanaf de start van de behandeling tot aan progressie of overlijden.
SPSS versie 26 is gebruikt voor de statistische analyses. De impact van comedicatie op de OS en PFS is bestudeerd met behulp van multivariabele cox-regressie analyses en Kaplan-Meiercurves. Alle variabelen met een P-waarde ≤ 0,15 in de univariabele analyse plus drie vooraf vastgestelde variabelen (type behandeling, functionele status (vastgelegd als Eastern Cooperative Oncology Group performance status [ECOG PS] en antibioticagebruik) zijn via backward-eliminatie verwerkt tot een finaal model. Vervolgens is bekeken of er sprake is van effectmodificatie. Met andere woorden: of de associatie tussen een microbioom-beïnvloedend geneesmiddel en uitkomsten afhankelijk is van type behandeling (immunotherapie of chemotherapie).
Resultaten
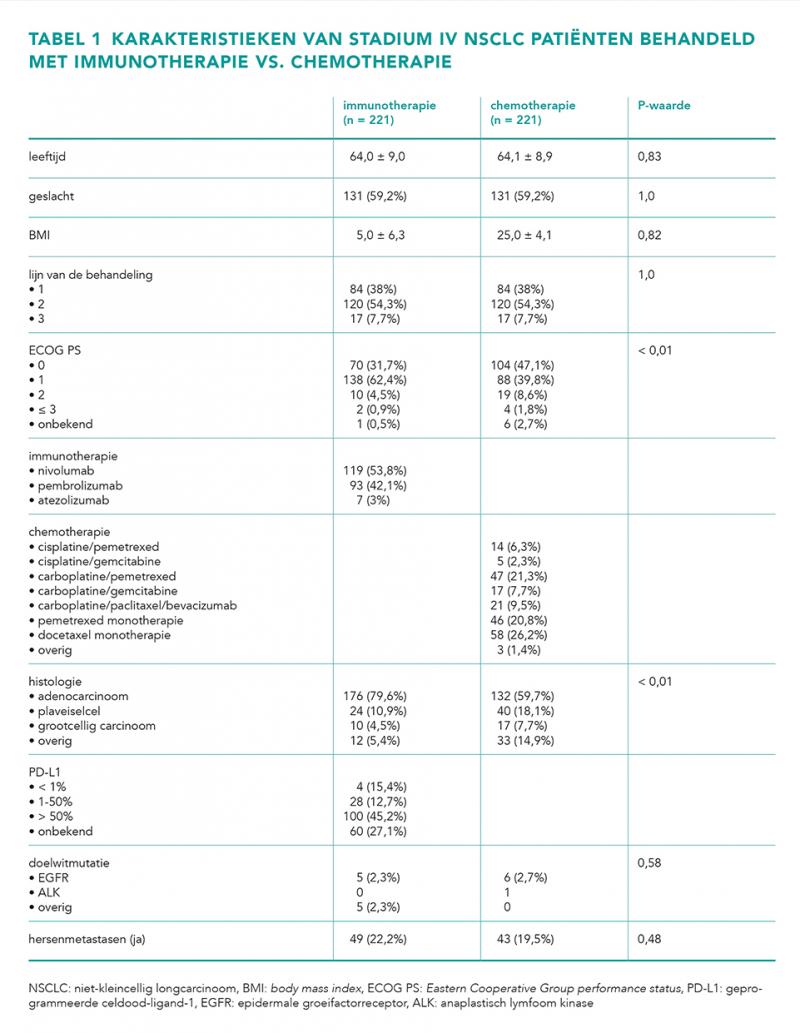
In totaal zijn er 442 stadium IV NSCLC-patiënten geïncludeerd in deze studie. De patiëntkarakteristieken worden weergegeven in tabel 1. Patiënten in de immunotherapiegroep hadden in vergelijking met de chemotherapiegroep vaker een ECOG PS van 1 (62,5% vs. 39,8%) en minder vaak een plaveiselcelcarcinoom (10,9% vs. 18,9%). Tabel 2 geeft een overzicht van de in gebruik zijnde comedicatie rondom de start van de systemische behandeling.
Algemene overleving (OS)
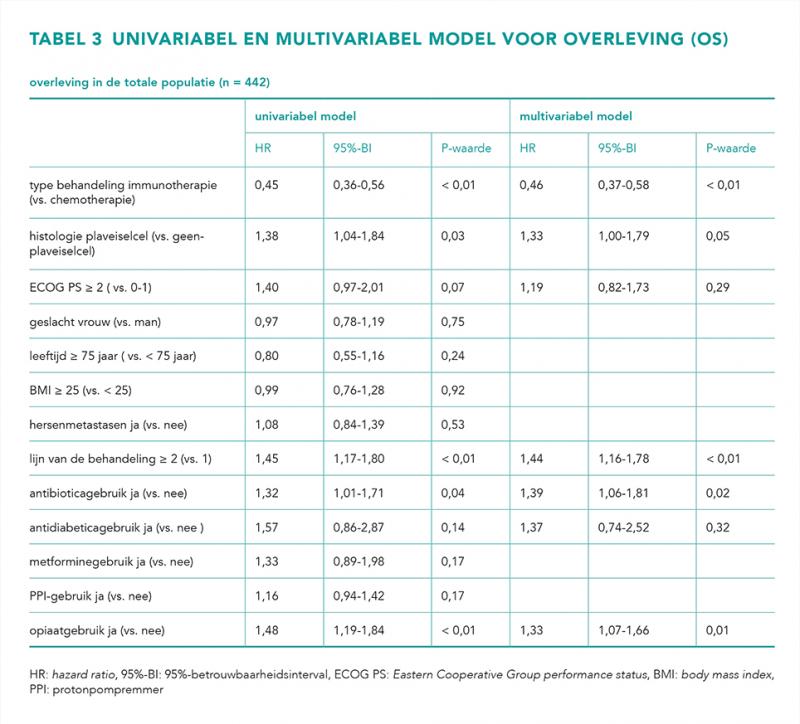
Uit het multivariabele model (tabel 3) blijkt dat het gebruik van antibiotica en opiaten significant geassocieerd is met een kortere overleving in de totale populatie, met een aHR van 1,39 (95%-betrouwbaarheidsinterval [95%-BI] = 1,06-1,81) voor antibioticagebruik en een aHR van 1,33 (95%-BI = 1,07-1,66) voor opiaatgebruik.
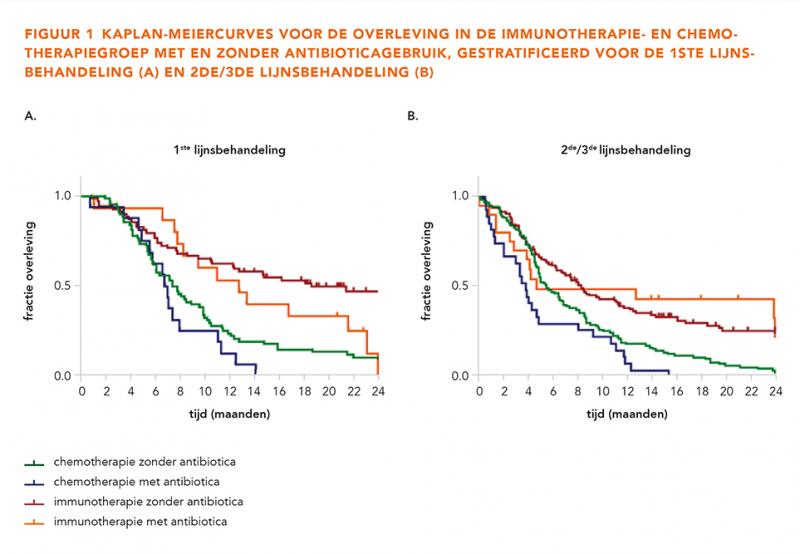
Het negatieve effect van antibioticagebruik op de overleving wordt gezien in zowel de chemotherapiegroep (aHR 1,46; 95%-BI = 1,04-2,05; P = 0,03) als in de immunotherapiegroep (aHR 1,20; 95%-BI = 0,79-1,85; P = 0,39). Deze bevinding wordt bevestigd met een niet-significante interactieterm tussen het gebruik van antibiotica en het type behandeling (P = 0,50). In figuur 1 worden per behandellijn de Kaplan-Meiercurves weergegeven voor de chemotherapie- en immunotherapiegroep wel en niet behandeld met antibiotica.
De associatie tussen opiaatgebruik en kortere overleving wordt ook gezien in beide groepen, met in de chemotherapie groep een aHR van 1,24 (95%-BI = 1,01-2,06; P = 0,04) en in de immunotherapie groep een aHR van 1,44 (95%-BI = 0,94-1,63; P = 0,13). De interactieterm tussen het gebruik van opiaten en het type behandeling is ook niet-significant (P = 0,50).
Progressievrije overleving (PFS)
In het multivariabele model is alleen het gebruik van antibiotica significant geassocieerd met slechtere PFS uitkomsten (aHR = 1,44; 95%-BI = 1,10-1,87), zie tabel 4. Het risico op progressie was groter in de chemotherapie groep dan in de immunotherapie groep, aHR 1,7 (95%-BI = 1,21-2,40; P < 0,01) en aHR 1,04 (95%-BI = 0,68-1,58; P = 0,86) respectievelijk. De interactieterm tussen het gebruik van antibiotica en het type behandeling was niet significant (P = 0,07).
Beschouwing
In deze studie is het gebruik van antibiotica en opiaten rondom de start van systeemtherapie bij uitgezaaide longkanker geassocieerd met slechtere overlevingsuitkomsten. De negatieve associaties werden gelijkend geobserveerd met zowel chemotherapie als immunotherapie. Dit betekent dat het aannemelijker is dat de slechtere uitkomsten het gevolg zijn van de toestand van de patiënt dan dat er sprake is van medicatiegerelateerde verstoringen van het microbioom.
Lurienne e.a. onderzocht in een meta-analyse de invloed van antibiotica op de effectiviteit van immunotherapie [10]. De auteurs vonden een pooled-hazard ratio voor OS van 1,69 (95%-BI = 1,25-2,29) voor patiënten die rondom de start van de immunotherapie ook antibiotica gebruikten. In onze studie vinden wij een hazard ratio van 1,20. Deze waarde is in dezelfde orde van grootte als de uitkomsten van de meta-analyse. Uit onze studie blijkt echter dat de associatie met antibiotica ook aanwezig is in de populatie die wordt behandeld met chemotherapie. Onder de aanname dat er geen relatie is tussen het microbioom en de effectiviteit van chemotherapie, is dit een aanwijzing dat confounding by indication een mogelijk verstorende factor is geweest in de eerder verschenen publicaties.
Onze bevindingen met betrekking tot het gebruik van opiaten komen goed overeen met de meta-analyse van Zheng e.a. waarin het gebruik van opiaten is geassocieerd met slechtere overlevingsuitkomsten in patiënten met kanker [11]. Andere studies hebben ook laten zien dat patiënten met kanker die opiaten gebruiken eerder overlijden aan de opiaatgerelateerde neveneffecten, zoals ademhalingsdepressie of delier [12]. Dit zijn effecten onafhankelijk van type systeemtherapie, zoals door onze studie ook gezien.
Het belangrijkste sterke punt van onze studie is de unieke opzet met historisch gematchte controles waardoor wij de mogelijke aanwezigheid van bias door confounding by indication beter konden onderzoeken. Een ander positief aspect van deze studie is dat we naast de invloed van antibiotica ook andere microbioom-beïnvloedende geneesmiddelen hebben meegenomen in de analyses.
Aan de andere kant heeft onze studie ook een aantal beperkingen. Een beperking is dat het corticosteroïdgebruik niet is meegenomen. Er zijn ook studies die het gebruik van corticosteroïden relateren aan een verminderde effectiviteit van immunotherapie, en het gebruik van corticosteroïden zou mogelijk kunnen samenhangen met het gebruik van de onderzochte microbioom-beïnvloedende geneesmiddelen. Hiernaast heeft onze studie te maken met alle beperkingen die horen bij een retrospectieve studie, waarbij informatiebias (zoals mogelijk niet volledig geregistreerde comedicatie in het EPD) de belangrijkste beperking is.
Conclusie
Samenvattend heeft deze studie bevestigd dat er een associatie is tussen het gebruik van antibiotica en opiaten en verminderde overleving met systeemtherapie in patiënten met stadium IV NSCLC. Dat de associatie niet verschilt tussen chemotherapie en immunotherapie maakt het aannemelijker dat de slechtere uitkomsten het gevolg zijn van de toestand van de patiënt dan dat er sprake is van medicatiegerelateerde verstoringen van het microbioom.
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. Leighl NB. Treatment paradigms for patients with metastatic non-small-cell lung cancer: first-, second-, and third-line. Curr Oncol. 2012;19(0):52–8.
2. Kastelijn EA, de Langen AJ, Peters BJM. Treatment of oncogene-driven non-small cell lung cancer. Curr Opin Pulm Med. 2019;25(3):300–7.
3. Iida N, Dzutsev A, Stewart CA, Smith L, Bouladoux N, Weingarten RA, et al. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment. Science (80- ). 2013;342(6161):967–70.
4. Routy B, Le Chatelier E, Derosa L, Duong CPM, Alou MT, Daillère R, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science (80- ). 2018;359(6371):91–7.
5. Zhao S, Gao G, Li W, Li X, Zhao C, Jiang T, et al. Antibiotics are associated with attenuated efficacy of anti-PD-1/PD-L1 therapies in Chinese patients with advanced non-small cell lung cancer. Lung Cancer. 2019;130:10–7.
6. Derosa L, Hellmann MD, Spaziano M, Halpenny D, Fidelle M, Rizvi H, et al. Negative association of antibiotics on clinical activity of immune checkpoint inhibitors in patients with advanced renal cell and non-small-cell lung cancer. Ann Oncol. 2018;29(6):1437–44.
7. Cramer-Van Der Welle CM, Peters BJM, Schramel FMNH, Klungel OH, Groen HJM, Van De Garde EMW. Systematic evaluation of the efficacy-effectiveness gap of systemic treatments in metastatic nonsmall cell lung cancer. Eur Respir J. 2018;52(6).
8. Maier L, Pruteanu M, Kuhn M, Zeller G, Telzerow A, Anderson EE, et al. Extensive impact of non-antibiotic drugs on human gut bacteria. Nature. 2018;555(7698):623–8.
9. Vich Vila A, Collij V, Sanna S, Sinha T, Imhann F, Bourgonje AR, et al. Impact of commonly used drugs on the composition and metabolic function of the gut microbiota. Nat Commun. 2020;11(1):1–11.
10. Lurienne L, Cervesi J, Duhalde L, de Gunzburg J, Andremont A, Zalcman G, et al. NSCLC Immunotherapy Efficacy and Antibiotic Use: A Systematic Review and Meta-Analysis. J Thorac Oncol. 2020;15(7):1147–59.
11. Zheng J, He J, Wang W, Zhou H, Cai S, Zhu L, et al. The impact of pain and opioids use on survival in cancer patients: Results from a population-based cohort study and a meta-analysis. Med (United States). 2020;99(9).
12. Hasegawa T, Oguri T, Osawa T, Sawa T, Osaga S, Okuyama T, et al. Opioid Dose and Survival of Patients with Incurable Nonsmall Cell Lung Cancer: A Prospective Cohort Study. J Palliat Med. 2018;21(10):1436–41.
Referentie
Citeer als: Verschueren MV, Cramer-van der Welle CM, Tonn M, Schramel FMNH, Peters BJM, van de Garde EMW. De invloed van microbioom-beïnvloedende comedicatie op de effectiviteit van immunotherapie in patiënten met stadium IV niet-kleincellige longkanker. Nederlands Platform voor Farmaceutisch Onderzoek. 2021;6:a1741.
DOI
https://www.knmp.nl/resolveuid/33fb2829934a4cfea8111c2c0a2ab7adOpen access



Reactie toevoegen