Interactie tussen valproïnezuur en meropenem: waarde van de vrije concentratie
- Rubriek: Casuïstische mededeling
- Identificatie: 2018;3:a1665
Kernpunten
- Gezien de therapeutische toepassing van carbapenems moet rekening worden gehouden met hypoalbuminemie bij het evalueren van de interactie met valproïnezuur.
- Een vrije concentratie, in plaats van een somspiegel van valproïnezuur, moet bepalend zijn voor het al dan niet ophogen van de dosering of therapieswitch bij patiënten met hypoalbuminemie.
- Bij hypoalbuminemie zijn de effecten van de interactie tussen carbapenems en valproïnezuur op de therapeutische vrije concentratie valproïnezuur mogelijk minder groot dan tot nu toe is aangenomen.
Abstract
Interaction between valproic acid and meropenem: significance of the free concentration
INTRODUCTION
Meropenem (MER) is a carbapenem antibiotic used in The Netherlands in critically ill patients. A clinically relevant interaction with valproic acid (VPA) has been described, potentially resulting in subtherapeutic levels of VPA. The combination is therefore discouraged.
DESCRIPTION
A 50-year-old patient in the intensive care unit was treated with intravenous (i.v.) VPA 800 mg twice daily and MER 1000 mg three times a day. Phenytoin 75 mg i.v. twice daily was added to prevent therapeutic failure due to interaction of MER and VPA. A sharp decline in total VPA levels to < 0.5 mg/ml was seen. After stopping MER, total VPA levels remained subtherapeutic and VPA dose was increased. No convulsions occurred during subtherapeutic anti-epileptic levels. Retrospectively, we measured unbound VPA concentrations in remaining samples. Free VPA levels after cessation of MER were all therapeutic or above.
DISCUSSION
The mechanism of interaction between carbapenems and VPA is unclear. Although declines in total blood levels of VPA have been seen, these did not always result in therapeutic failure. In most reports, no information is given on free VPA concentrations or albumin levels. Here we show that in hypoalbuminaemia, total VPA levels are misleading in evaluating the combination of MER and VPA and this may inadvertently lead to overdosing of VPA.
CONCLUSION
Due to hypoalbuminaemia in critically ill patients, VPA and its interaction with MER should be monitored based on free concentrations, to prevent overdosing of VPA or unnecessary switching to other anti-epileptics.
Inleiding
Meropenem, een carbapenemantibioticum, wordt in Nederland ingezet op intensivecare-units (IC’s) bij infecties ten gevolge van multiresistente bacteriën. Carbapenems hebben weinig interacties, echter een bekende klinisch relevante interactie is die met valproïnezuur. Er zijn diverse casus beschreven van een snelle daling van valproïnezuurspiegels bij gelijktijdig gebruik van meropenem [1-6]. Het advies bij deze interactie is dan ook de combinatie te vermijden. In veel gevallen zal dat switchen naar een ander anti-epilepticum betekenen, omdat staken van het carbapenem geen optie (meer) is. Hier beschrijven we een casus waarin de klinische afhandeling van deze interactie achteraf een ongewenst effect blijkt te hebben gehad.
Casusbeschrijving
Een 50-jarige patiënt werd opgenomen op de IC met acute respiratoire insufficiëntie bij pneumonie op basis van een multiresistente bacterie. Er was sprake van secundair gegeneraliseerde epilepsie door meerdere doorgemaakte cerebrovasculaire accidenten. De thuismedicatie bestond uit carbasalaatcalcium 1 dd 100 mg, esomeprazol 1dd 10 mg, atorvastatine 1dd 40 mg, valproïnezuur 2 dd 800 mg (oraal), loperamide 3 dd 1 mg (drank) en diazepam klysma 10 mg zo nodig.
Bij opname op de IC werd valproïnezuur oraal omgezet naar i.v. en gestart met meropenem 3 dd 1000 mg i.v. Vanwege de interactie meropenem-valproïnezuur werd besloten fenytoïne 2 dd 75 mg i.v. toe te voegen. De valproïnezuurspiegel voor opname op de IC was 53 mg/ml. Vervolgens werd echter alleen nog de totale fenytoïnespiegel gemonitord. Deze bedroeg twee en vijf dagen na start respectievelijk 0,8 mg/l en 1,4 mg/l. De patiënt knapte op en werd zes dagen na opname overgeplaatst naar de afdeling. De (relevante) medicatie bij overplaatsing was valproïnezuur i.v. 2 dd 800 mg, fenytoïne i.v. 2 dd 75 mg en meropenem 3 dd 1000 mg. Er traden geen convulsies op gedurende deze behandeling. Vanwege verdere verbetering werden meropenem en fenytoïne twee dagen na overplaatsing gestopt (therapieduur 10 dagen).
Een dag later ontwikkelde de patiënt opnieuw koorts, liepen infectieparameters op, en werden meropenem en fenytoïne herstart in de eerdere dosering. De patiënt ging weer naar de IC. Op dag 4 na herstart waren somspiegels (totaal van albuminegebonden en vrije concentratie) van valproïnezuur en fenytoïne respectievelijk 1 mg/l en < 0,5 mg/l. Hierop werd de dosis fenytoïne verhoogd naar 3 dd 75 mg i.v. Op dag 6 na herstart werd een toename van de hoeveelheid pleuravocht gezien en volledige atelectase van de linker long. Behandeling met meropenem werd daarop gestaakt. Valproïnezuur en fenytoïne werden beide gehandhaafd, omdat onduidelijk is hoe snel na stoppen van meropenem de valproïnezuurspiegel stijgt. Vier dagen na het stoppen van meropenem was de valproïnezuurspiegel gestegen naar 27 mg/l en deze bleef vervolgens bij gelijkblijvende dosis stabiel gedurende de volgende twee dagen. Aangezien de spiegel met deze oorspronkelijke dosis nog niet op de uitgangswaarde was van voor de interactie met meropenem, werd de dosis alsnog opgehoogd naar 3 dd 800 mg. De spiegel vier dagen later bedroeg 40 mg/l. De patiënt was inmiddels dermate verzwakt dat deze uiteindelijk overleed aan de gevolgen van de pneumonie.
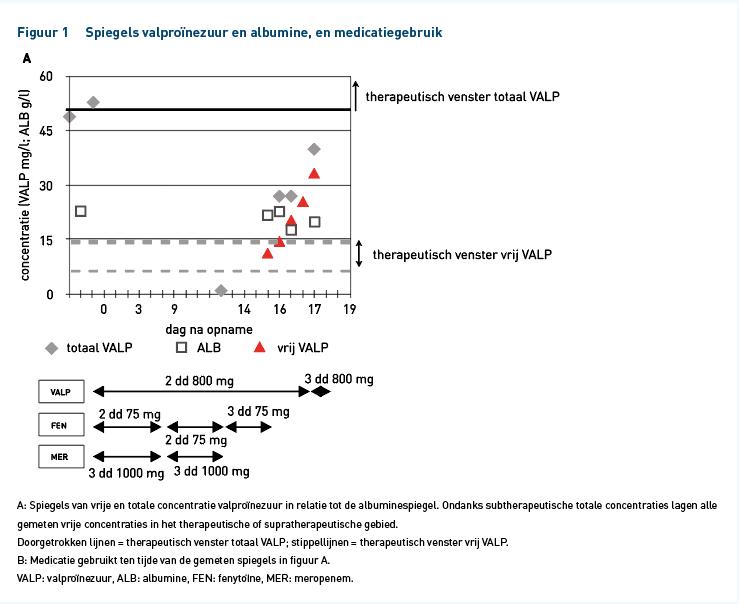
Om het ontbreken van therapiefalen te kunnen verklaren, hebben wij retrospectief de vrije (niet-albuminegebonden) concentraties van valproïnezuur en de albuminespiegels gemeten in de nog beschikbare monsters. De valproïnezuurconcentraties werden bepaald met de Online TDM Valproic Acid-test op een Cobas analyzer (Roche Diagnostics, Mannheim), met de vrije concentraties na ultracentrifugatie van de monsters met een Centifree Ultrafiltration Device (Merck/Millipore, Amsterdam). In figuur 1 is te zien dat ondanks de subtherapeutische totale valproïnezuurspiegels die gemeten werden na stoppen van meropenem, de vrije concentraties nog binnen het therapeutisch venster (5-15 mg/l [7]) bleven. Zoals kan worden verwacht bij een IC-patiënt met een infectie, waren de albuminespiegels verlaagd, namelijk circa 20 g/l (normaal: 35-50 g/l). De dosisverhoging die werd geadviseerd op basis van de totale spiegels resulteerde door deze hypoalbuminemie in een verhoging van de vrije valproïnezuurconcentratie tot ver boven het therapeutische gebied (figuur 1). Helaas waren er geen monsters meer beschikbaar voor bepaling van de vrije valproïnezuurconcentratie ten tijde van gelijktijdige toediening met meropenem. De gemeten somspiegel van 1 mg/l valproïnezuur kan echter maximaal een vrije concentratie van eveneens 1 mg/l hebben opgeleverd.
Beschouwing
Het onderliggende mechanisme van de interactie van meropenem met valproïnezuur is onduidelijk. Er wordt gesuggereerd dat de orale absorptie van valproïnezuur wordt verminderd door aantasting van de darmflora door meropenem [8-9]. In deze casus werd echter een extreme daling van de valproïnezuurspiegel gezien, ondanks dat het i.v. werd toegediend. Een andere hypothese is een verhoogde renale uitscheiding van valproïnezuur door toename van UDP-glucuronzuur, een cofactor bij de glucuronidering van valproïnezuur [8-9]. Verder zijn nog gesuggereerd: remming van bètaglucuronidase in de darm en daardoor een verminderde enterohepatische kringloop, remming van de hydrolyse van valproïnezuurglucuronide naar valproïnezuur in de lever [9-10] of een toename van de distributie van valproïnezuur naar erytrocyten [8-9]. Binding van meropenem aan albumine is circa 2% [11], dus verdringing van valproïnezuur door meropenem is onwaarschijnlijk.
Casuïstische mededelingen beschrijven een daling van valproïnezuurspiegels binnen 24 uur na starten met carbapenems. In een aantal gevallen resulteerde dit in therapiefalen [3-4], maar er zijn ook casus waarin patiënten met verlaagde spiegels aanvalsvrij bleven [3-4,12]. In onderhavige casus werden inderdaad zeer lage totale spiegels gevonden bij gelijktijdig gebruik van meropenem, bovendien bij een intraveneuze dosering die gelijk was aan de eerdere orale dosis in de thuissituatie. Doordat naast meropenem ook fenytoïne werd toegediend is niet duidelijk in welke mate inductie van het valproïnezuurmetabolisme door fenytoïne aan deze lage spiegel heeft bijgedragen. Er was geen andere interacterende medicatie in het spel.
Gewoonlijk is de vrije concentratie valproïnezuur door de hoge mate van eiwitbinding circa 10%. Bij deze patiënt zijn gedurende de behandeling met meropenem geen albumine of vrije concentraties van fenytoïne of valproïnezuur bepaald. Aangezien de patiënt al bijna twee weken was opgenomen met een pneumonie, was een hypoalbuminemie te verwachten, met gevolgen voor de vrije concentratie van zowel fenytoïne als valproïnezuur. Hoewel er voor fenytoïne, gezien de niet-lineaire kinetiek, een groter risico op overdosering is bij hypoalbuminemie dan voor valproïnezuur [13-14], zijn diverse casus beschreven met een significante verhoging van de vrije concentratie valproïnezuur bij hypoalbuminemie met als gevolg neurotoxiciteit, lethargie en trombocytopenie [7,15-17].
In de huidige casus zijn vanwege subtherapeutische somspiegels de doseringen van de anti-epileptica verhoogd. Ondanks de goed gedocumenteerde interactie van meropenem met valproïnezuur wordt er vrijwel nergens melding gemaakt van albuminespiegels bij patiënten met deze interactie. Alleen Spriet et al. rapporteren verlaagde albuminespiegels bij 2 patiënten met therapiefalen op valproïnezuur [1]. Het is daarom de vraag of bij alle eerdere meldingen van deze interactie ook daadwerkelijk sprake was van een subtherapeutische concentratie vrij valproïnezuur. Temeer omdat in veel gevallen de somspiegel minder daalde dan bij onze patiënt (tot circa 5-30 mg/l) en slechts in ongeveer 50% van de gerapporteerde casus sprake was van therapiefalen [1,3,18]. Wij zagen initieel een zeer sterke daling tot 1 mg/ml, wat ook leidt tot een subtherapeutische vrije concentratie. Het lijkt er echter op, dat na staken van meropenem een herverdeling plaatsvindt naar vrij valproïnezuur: nog vóór de dosisverhoging steeg de vrije concentratie bij een gelijkblijvend albumineniveau, met subtherapeutische somspiegels en (supra)therapeutische vrije concentraties tot gevolg. Bij onze patiënt is onder andere dyspnoe, hypotensie en verminderd bewustzijn waargenomen. Het is niet uitgesloten dat deze symptomen (mede) het gevolg waren van overdosering en toxische valproïnezuurspiegels.
Conclusie
Meropenem wordt, zeker in Nederland, vrijwel alleen gebruikt bij kritisch zieke patiënten. Daarbij moet rekening worden gehouden met een bestaande hypoalbuminemie. Bij patiënten die zowel meropenem als valproïnezuur gebruiken, of na staken van meropenem doorgaan met valproïnezuur, is doseren op basis van de vrije concentratie valproïnezuur noodzakelijk. Alleen als de vrije concentratie daartoe aanleiding geeft is switchen naar een anti-epilepticum zonder deze interactie en met weinig albuminebinding aangewezen. Of bij hypoalbuminemie de klinische consequenties van deze interactie even groot zijn als bij normale albuminespiegels, verdient nader onderzoek.
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. Spriet I, Meersseman W, De Troy E, Wilmer A, Casteels M, Willems L. Meropenem-valproic acid interaction in patients with cefepime-associated status epilepticus. Am J Health Syst Pharm. 2007 Jan 1;64(1):54-8.
2. Fudio S, Carcas A, Piñana E, Ortega R. Epileptic seizures caused by low valproic acid levels from an interaction with meropenem. J Clin Pharm Ther. 2006 Aug;31(4):393-6.
3. Baxter K, red. Stockley’s Drug Interactions, 8th ed. Londen: Pharmaceutical Press, 2008.
4. Spriet I, Goyens J, Meersseman W, Wilmer A, Willems L, Van Paesschen W. Interaction between valproate and meropenem: a retrospective study. Ann Pharmacother. 2007 Jul;41(7):1130-6.
5. Coves-Orts FJ, Borrás-Blasco J, Navarro-Ruiz A, Murcia-López A, Palacios-Ortega F. Acute seizures due to a probable interaction between valproic acid and meropenem. Ann Pharmacother. 2005 Mar;39(3):533-7.
6. Haroutiunian S, Ratz Y, Rabinovich B, Adam M, Hoffman A. Valproic acid plasma concentration decreases in a dose-independent manner following administration of meropenem: a retrospective study. J Clin Pharmacol. 2009 Nov;49(11):1363-9.
7. de Maat MM, van Leeuwen HJ, Edelbroek PM. High unbound fraction of valproic acid in a hypoalbuminemic critically ill patient on renal replacement therapy. Ann Pharmacother. 2011 Mar;45(3):e18.
8. Mori H, Takahashi K, Mizutani T. Interaction between valproic acid and carbapenem antibiotics. Drug Metab Rev. 2007;39(4):647-57.
9. Mancl EE, Gidal BE. The effect of carbapenem antibiotics on plasma concentrations of valproic acid. Ann Pharmacother. 2009 Dec;43(12):2082-7.
10. Suzuki E, Nakai D, Yamamura N, Kobayashi N, Okazaki O, Izumi T. Inhibition mechanism of carbapenem antibiotics on acylpeptide hydrolase, a key enzyme in the interaction with valproic acid. Xenobiotica. 2011 Nov;41(11):958-63.
11. Pfizer B.V. SmPC Meronem [internet]. Utrecht: College ter beoordeling van Geneesmiddelen 2017 [geraadpleegd 25-7-2017]. https://db.cbg-meb.nl/IB-teksten/h17864.pdf.
12. Clause D, Decleire PY, Vanbinst R, Soyer A, Hantson P. Pharmacokinetic interaction between valproic acid and meropenem. Intensive Care Med. 2005 Sep;31(9):1293-4.
13. NVZA Commissie Analyse en Toxicologie. TDM-monografie fenytoïne [internet]. 2014 [geraadpleegd 25-7-2017] http://tdm-monografie.org/monografie/fenytoine.
14. NVZA Commissie Analyse en Toxicologie. TDM-monografie valproïnezuur [internet]. 2014 [geraadpleegd 25-7-2017] http://tdm-monografie.org/monografie/valproinezuur.
15. Gidal BE, Collins DM, Beinlich BR. Apparent valproic acid neurotoxicity in a hypoalbuminemic patient. Ann Pharmacother. 1993 Jan;27(1):32-5.
16. Hermida J, Tutor JC. A theoretical method for normalizing total serum valproic acid concentration in hypoalbuminemic patients. J Pharmacol Sci. 2005 Apr;97(4):489-93.
17. Haroldson JA, Kramer LE, Wolff DL, Lake KD. Elevated free fractions of valproic acid in a heart transplant patient with hypoalbuminemia. Ann Pharmacother. 2000 Feb;34(2):183-7.
18. KNMP-WinAp. Risicoanalyse valproïnezuur + meropenem [internet]. 2007 [geraadpleegd 22-03-2017] https://kennisbank.knmp.nl/files/interacties/I0004286.PDF.
Referentie
Citeer als: Derijks-Engwegen JYMN, Derijks LJJ. Interactie tussen valproïnezuur en meropenem: waarde van de vrije concentratie. Nederlands Platform voor Farmaceutisch Onderzoek. 2018;3:a1665.
DOI
https://www.knmp.nl/resolveuid/f8cb3e5fbb7b409697b253f07cfc24c8Open access

Reactie toevoegen